理論化学
化学講座 第32回:熱化学方程式②【化学反応と熱の出入り】
状態変化を表す式や化学反応式に熱量を組み込んだものを熱化学方程式と言います。今回は熱化学方程式の作り方と意味について説明します。
さて、まずは、化学反応や状態変化の時に生じる熱についての定義を覚えましょう。前回、状態変化に伴う熱について説明しましたが、復習のためにこれも載せておきます。
状態変化に伴う熱量
| 熱の名称 | 定義 |
|---|---|
| 融解熱 | 1molの固体が液体になるときに必要な熱量 |
| 蒸発熱 | 1molの液体が気体になるときに必要な熱量 |
| 凝固熱 | 1molの液体が固体になるときに放出する熱量 |
| 凝縮熱 | 1molの気体が液体になるときに放出する熱量 |
| 昇華熱 | 1molの物質が昇華するときに必要な熱量 |
思い出しましたか?どれも物質1molあたりについての熱量であることに注意してくださいね。では、次に、化学反応に伴う熱のうち、代表的なものを下にまとめておきます。
化学変化に伴う熱量
| 熱の名称 | 定義 |
|---|---|
| 燃焼熱 | 1molの物質が完全燃焼するときに発生する熱量 |
| 生成熱 | 1molの物質が単体から生成するときに発生する熱量 |
| 中和熱 | 1molの H+とOH-から1molのH2O が生じる時に発生する熱量 |
燃焼熱は、物質が完全燃焼するときに発生する熱量です。完全燃焼というのは、物質が酸素と化合してCO2、H2O、SO2になる事です。これら以外の物質が生成される反応は、燃焼反応ではありません。
生成熱はよく誤解されますが、1molの物質が、その構成単体から生じるときに発生する熱量です。
中和熱は、1molのH+とOH-から1molのH2O が生じる時に発生する熱量ですので、酸や塩基の種類によって大きさは変わりません。ただ、酸や塩基が弱酸・弱塩基の場合は、電離するときに吸熱をしますので、強酸・強塩基の中和反応よりも放出される熱量が小さくなることがあります。
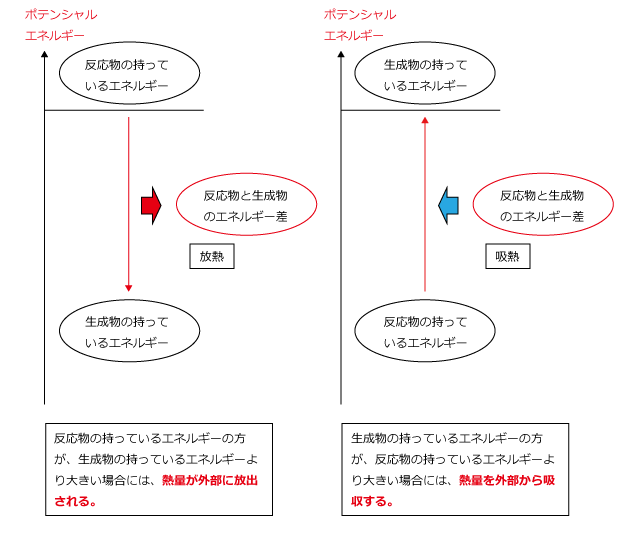
ところで、ここで放出あるいは吸収される熱量は一体何かというと、状態変化あるいは化学反応の前後での物質の持つエネルギーの差です。
化学反応や状態変化で、反応前の物質の持っているエネルギーが反応後の物質の持つエネルギーより大きければ、その差が外部に放出されますし、反応前の物質の持つエネルギーの方が小さければ、その差が外部から吸収されます。