理論化学
無機化学
第12回 遷移元素②(Cu、Ag)
銅
銅の性質
銅は赤みを帯びた金属光沢を持ち、展性・延性に富む。また、電気伝導性はAgに次いで二番目に大きく、電線などの材料として多用される。 単体を1000℃以下で加熱すると酸化銅(Ⅱ)(CuO:黒色)となるが、1000℃以上に加熱すると酸化銅(Ⅰ)(Cu2 O:赤色)となる。さらに加熱すると 2000℃ で分解して銅に戻る。 また、湿気を含む空気中に放置すると緑色の錆(緑青)を生じる。
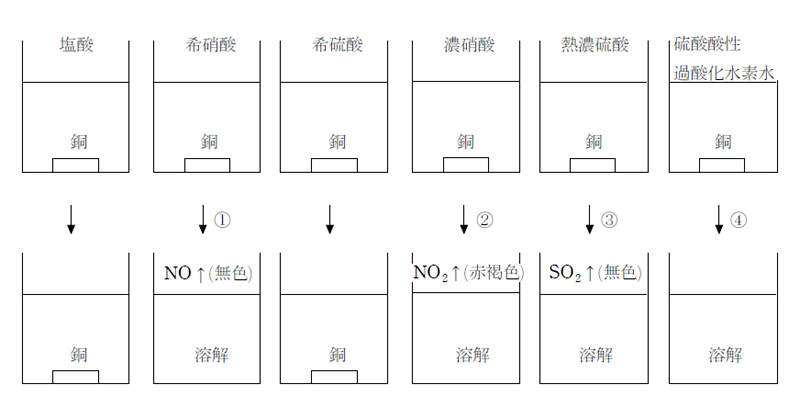
銅は水素よりイオン化傾向が小さいため、希酸には溶けないが、酸化力のある硝酸(濃硝酸!希硝酸)や熱濃硫酸、硫酸酸性の過酸化水素水には気体を発生して溶ける。
- ① 3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O
- ② Cu+4HNO3→Cu(NO3)2+2NO2↑+2H2O
- ③ Cu+2H2SO4→CuSO4+SO2+2H2O
- ④ Cu+H2O2+H2SO4→CuSO4+2H2O
③の反応によって得られる硫酸銅の結晶は、青色の硫酸銅五水和物CuSO4・5H2Oとして得られる。 硫酸銅五水和物の五つの結晶水のうち四分子はCu2+に直接配位しており、残りの一分子はCu2+と結合しているSO42- 同士を結びつけている(陰イオン水)。 陰イオン水はCu2+に直接配位しているH2Oとも水素結合するため、Cu2+に直接配位している四分子のH2Oのうち二分子は陰イオン水とも結合している。(下図)
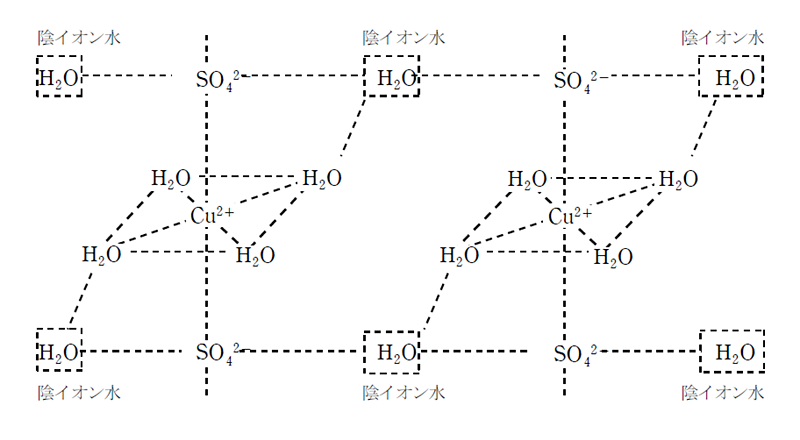
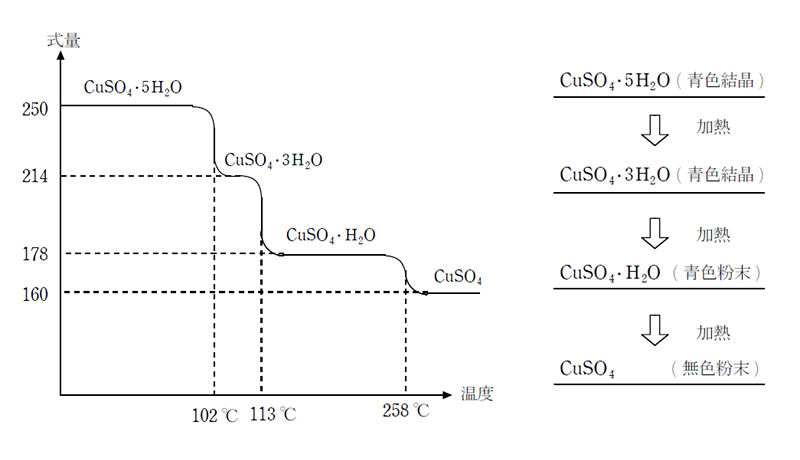
CuSO4・5H2Oを加熱すると、まずCu2+に配位しているH2Oうち、陰イオン水と結合していない2分子が脱離してCuSO4・3H2O(青色結晶)になり、更に加熱するとCu2+に配位している2分子が脱離してCuSO4・H2O(青色粉末)になる。 更に250℃に加熱すると、最後まで残っていた陰イオン水が脱離して、白色粉末のCuSO4になる。 CuSO4は白色であるが、水を加えると直ちに青色を呈するため、水の検出試薬として用いられる。
銅のイオンは水溶液中で青色であり、緑色の炎色反応を示す。Cu2+を含む水溶液にNaOHまたはNH3を加えると、Cu(OH)2の青白色沈殿が生じるが、これは多量のアンモニアを加えることによって溶解し、 テトラアンミン銅(Ⅱ)イオンの深青色溶液となる。銅の錯イオンは正四角形をしている。
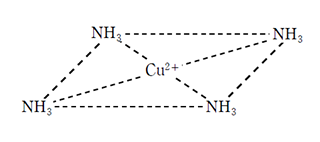
Cu(OH)2+4NH3→[Cu(NH3)4](OH)2
また、Cu(OH)2の沈殿を加熱すると、黒色のCuOを生じる。
Cu(OH)2→CuO+H2O
Cu2+はS2-と結びつきやすく、CuSの難溶性黒色沈殿を生じる。
Cu2++S2-→CuS
CuO はアンモニア水、塩化アンモニウム水溶液にはアンミン錯イオンとなって溶解するが、CuS は溶解しない。
CuO+4NH3+2H2O→[Cu(NH3)4](OH)2
2CuO+4NH4Cl→CuCl2+[Cu(NH3)4]Cl2+H2O
また、Cu2+に[Fe(CN)6]4-を加えるとヘキサシアノ鉄(Ⅱ)酸銅(Ⅱ)の赤褐色沈殿を生じる。
2Cu2++[Fe(CN)6]4-→Cu2[Fe(CN)6]
銅の精錬
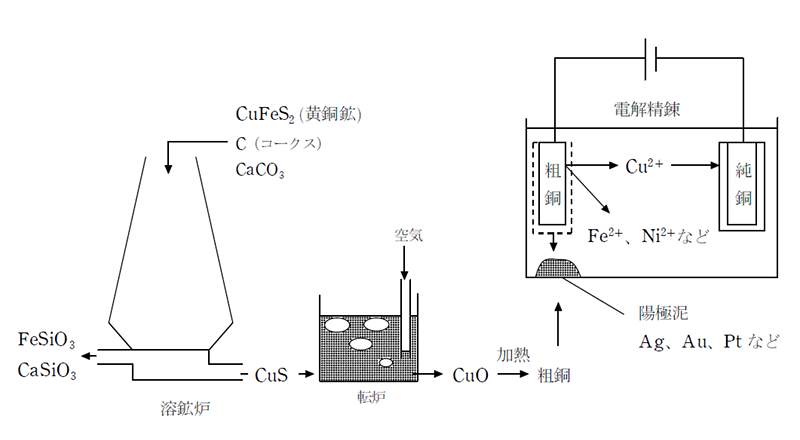
銅は主に黄銅鉱(CuFeS2)として産出する。これをコークス(C)、石灰石(CaCO3)と共に溶鉱炉で強熱すると、硫化銅(Ⅰ)(Cu2S)とケイ酸鉄(Ⅱ)(FeSiO3)、ケイ酸カルシウム(CaSiO3) に分離される。
4CuFeS2+9O2→2Cu2S+2Fe2O3+6SO2
2Fe2O3+C+4SiO2→4FeSiO3+CO2
SiO2+CaCO3→CaSiO3+CO2
次に、Cu2Sを転炉に移して酸素を吹き付けると、硫黄が二酸化硫黄となり銅は酸化銅(Ⅰ)となる。
これを2000℃以上に加熱すると還元が起こり、銅が生じる。
2Cu2S+3O2→2Cu2O+2SO2
4Cu2O→4Cu+O2
このようにして得られた銅は純度が99%程度で、Fe、Ni、Pb、Au、Agなどの金属を不純物として含み、粗銅と呼ばれる。 この粗銅を陽極に用いた電解精錬により、純度99.99%の純銅が得られる。このとき、不純物のうち、Cuよりイオン化傾向の大きなFe、Niなどは水溶液中にイオンとして留まり、Cuよりイオン化傾向の小さなAu、Agなどは陽極泥として粗銅板の下に沈殿する。 また、PbはCuよりイオン化傾向が大きいが、溶液中のSO42- と結合して水に不溶のPbSO4になり沈殿する。
【陽極】Cu→Cu2++2e-
【陰極】Cu2++2e-→Cu
銅の製法
銅は合金を作りやすく、Cu と Zn の合金を黄銅(しんちゅう)、Cu と Sn の合金を青銅、Cu と Niの合金を白銅という。
Cu の関連図と化学反応式
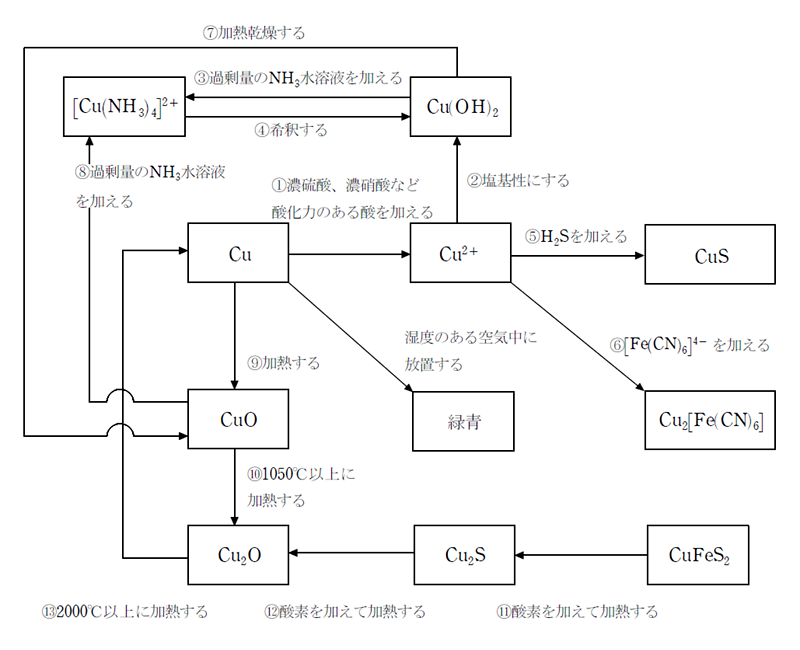
化学反応式
- ① 3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3→Cu(NO3)2+2NO2↑+2H2O
Cu+2H2SO4→CuSO4+SO2+2H2O
Cu+H2O2+H2SO4→CuSO4+2H2O - ② Cu2++2OH-→Cu(OH)2
- ③ Cu(OH)2+4NH3→[Cu(NH3)4](OH)2
- ④ [Cu(NH3)4](OH)2→Cu(OH)2+4NH3
- ⑤ Cu2++S2-→CuS
- ⑥ 2Cu2++[Fe(CN)6]4-→Cu2[Fe(CN)6]
- ⑦ Cu(OH)2→CuO+H2O
- ⑧ CuO+4NH3+2H2O→[Cu(NH3)4](OH)2
- ⑨ 2Cu+O2→2CuO
- ⑩ 4CuO→2Cu2O+O2
- ⑪ 4CuFeS2+9O2→2Cu2S+2Fe2O3+6SO2
- ⑫ 2Cu2S+3O2→2Cu2O+2SO2
- ⑬ 4Cu2O→4Cu+O2
銀
銀の性質
銀は電気や熱をもっとも良く導く金属で、展性延性の大きな金属である。空気中に放置しても酸化されにくいが、硫化水素とは容易に反応して黒色の硫化銀(Ag2S)を生じる。 銀は水素よりイオン化傾向が小さいため、銅と同様に希酸には溶けないが、酸化力のある熱濃硫酸、希硝酸、濃硝酸には溶ける。
① 3Ag+4HNO3→3AgNO3+2H2O+NO↑
② Ag+2HNO3→AgNO3+H2O+NO2↑
③ 2Ag+2H2SO4→Ag2SO4+2H2O+SO2↑
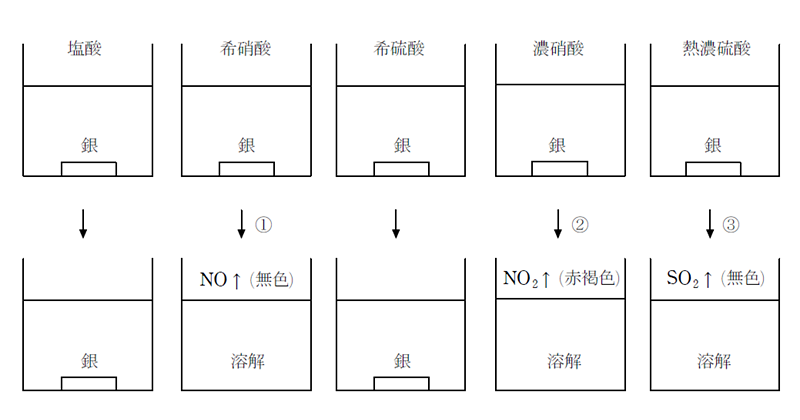
AgをHNO3に溶かした時に得られる硝酸銀は、無色の結晶で水によく溶け、Ag+を生じる。Ag+を含む水溶液にNaOHまたはNH3を加えると褐色の酸化銀Ag2Oが沈殿する。
2Ag++2OH-→Ag2O+H2O
このAg2Oの褐色沈殿に過剰量のNH3を加えると、直線形の錯イオン、ジアンミン銀(Ⅰ)イオンとなって溶解するが、過剰量のNaOHを加えても錯イオンは形成されない。 Ag2Oは他にもチオ硫酸イオンやシアン化物イオンとも錯イオンを作るため、Na2S2O3やKCNなどの水溶液にも溶解する。
Ag2Oに過剰量のNH3水溶液を加える:Ag2O+H2O+4NH3→2[Ag(NH3)2]OH
Ag2OにNa2S2O3水溶液を加える:Ag2O+H2O+4Na2S2O3→2Na3[Ag(S2O3)2]+2NaOH
Ag2OにKCN水溶液を加える:Ag2O+H2O+4KCN→2K[Ag(CN)2]+2KOH
また、Ag2Oを強熱すると、容易に分解してAgを遊離する。
2Ag2O→4Ag+O2
Ag+は酸性条件でもH2S 水溶液によってAg2S の黒色沈殿を作るが、Ag2SはNH3水溶液やNa2S2O3水溶液に溶けず、KCN 水溶液にはわずかに解ける。
2Ag++S2-→Ag2S
| Ag2O | Ag2S | |
|---|---|---|
| NH3水溶液 | [Ag(NH |
溶解しない |
| Na2S2O3水溶液 | [Ag(S2O3)2]2- | 溶解しない |
| KCN水溶液 | [Ag(CN)2]- | わずかに溶ける |
アンモニア性硝酸銀水溶液に還元性のある物質 (アルデヒド等) を加えると銀の単体が析出する。
Ag++e-→Ag
この反応を銀鏡反応といい、還元性物質の検出に利用される。
Ag+はハロゲン化物イオンと反応してハロゲン化銀を生成する。
Ag++F-→AgF(黄)
Ag++Cl-→AgCl(白)
Ag++Br-→AgBr(淡黄)
Ag++I-→AgI(黄)
これらのハロゲン化銀のうちAgFは他の3種類のハロゲン化銀と異なる性質を示す。
① AgFは水に良く溶けるが、他の3種類は水に溶けない。
② AgFは感光性が弱いが、他の3種類は感光性が強い。
水に溶けにくいハロゲン化銀のうちAgBrとAgClは、NH3 水溶液やKCN水溶液、Na2S2O3水溶液を加えると錯イオンとなって溶解するが、AgIはNH3とは錯イオンを作らず、溶解しない。 Agのハロゲン化物は光によって分解しやすい(感光性)。そのため保存するときは褐色びんに保存する。AgClやAgBrは写真の感光剤として用いられるが、AgIは赤外線により感光するため、通常の写真などの感光材としては用いられない。
2AgBr→2Ag+Br2
2AgCl→2Ag+Cl2
2AgI→2Ag+I2
| AgF | AgCl | AgBr | AgI | |
|---|---|---|---|---|
| 水溶性 | 溶解する | 溶解しない | 溶解しない | 溶解しない |
| 感光性 | あり | あり | あり | 赤外線で感光 |
| NH3水溶液 | [Ag(NH3)2]+ | [Ag(NH3)2]+ | [Ag(NH3)2]+ | 溶解しない |
| Na2S2O3水溶液 | [Ag(S2O3)2]2- | [Ag(S2O3)2]2- | [Ag(S2O3)2]2- | [Ag(S2O3)2]2- |
| KCN水溶液 | [Ag(CN)2]- | [Ag(CN)2]- | [Ag(CN)2]- | [Ag(CN)2]- |
Ag の関連図と化学反応式
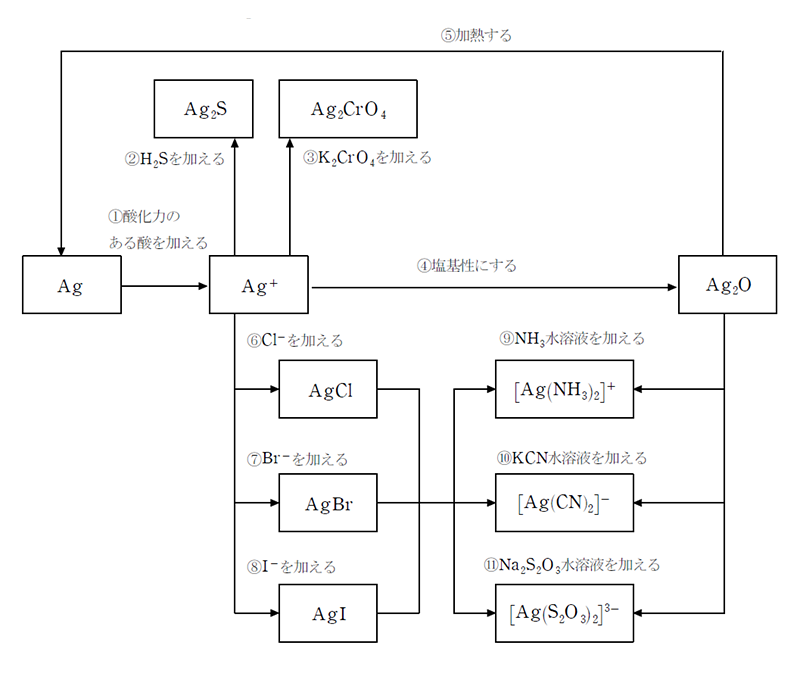
化学反応式
- ① 3Ag+4HNO3→3AgNO3+2H2O+NO↑
Ag+2HNO3→AgNO3+H2O+NO2↑
2Ag+2H2SO4→Ag2SO4+2H2O+SO2↑ - ② 2Ag++S2-→Ag2S
- ③ 2Ag++CrO42-→Ag2CrO4
- ④ 2Ag++2OH-→Ag2O+H2O
- ⑤ 2Ag2O→4Ag+O2
- ⑥ Ag++Cl-→AgCl
- ⑦ Ag++Br-→AgBr
- ⑧ Ag++I-→AgI
- ⑨ AgCl+2NH3→[Ag(NH3)2]Cl
Ag2O+4NH3+H2O→2[Ag(NH3)2](OH) - ⑩ AgCl+2KCN→K[Ag(CN)2]+KCl
Ag2O+4KCN+H2O→2K[Ag(CN)2]+2KOH - ⑪ AgCl+2Na2S2O3+H2O→Na3[Ag(S2O3)2]+NaCl
Ag2O+4Na2S2O3+H2O→2Na3[Ag(S2O3)2]+2NaOH