理論化学
無機化学
第13回 遷移元素③(Cr,Mn,Hg)
クロム
クロムの性質
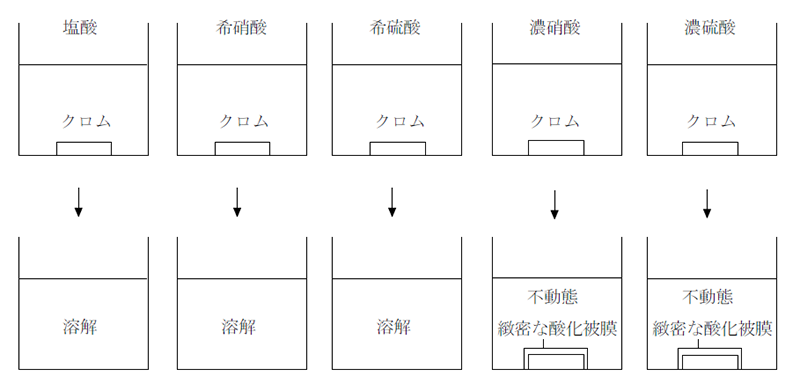
クロムは銀白色の光沢をもち、硬くて融点が高い金属である。常温では酸化されにくい金属であるが、水素よりイオン化傾向が大きいため、希塩酸や希硫酸には溶ける。
しかし不動態を作るため、濃硝酸や濃硫酸には溶解しない。
2Cr+6HCl→2CrCl3+3H2
クロムは酸化数+Ⅱ、+Ⅲ、+Ⅵの化合物が存在し、+Ⅲの化合物が最も安定である。そのため、+Ⅵの化合物である二クロム酸イオン:Cr2O72-(赤橙色)やクロム酸イオン:CrO42-(黄色) は酸性水溶液中で強い酸化力を示し、Cr3+(暗緑色)へ変化する。
Cr2O72-+14H++6e-→2Cr3++7H2O
CrO42-+8H++3e-→Cr3++4H2O
Cr3+を含む溶液に塩基水溶液を少量加えると、Cr(OH)3の灰緑色沈殿が生じる。
Cr3++3OH-→Cr(OH)3
Cr(OH)3を加熱脱水すると、緑色のCr2O3が生じる。これはビリジアンと呼ばれ、緑色の絵の具として用いられる。
2Cr(OH)3→Cr2O3+3H2O
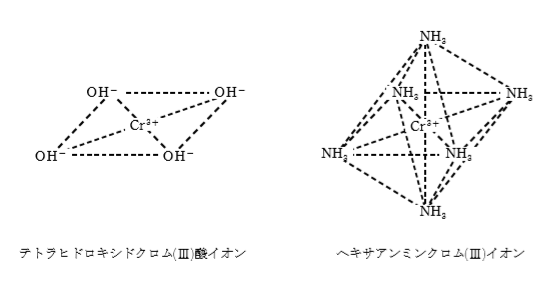
Cr(OH)3は両性水酸化物であるから、過剰のNaOHを加えると[Cr(OH)4]- (緑色)となって溶解する。
また、NH3 とも錯イオンを作るが、配位子がNH3の場合、正八面体の六配位型になる。
Cr(OH)3に過剰のNaOH水溶液を加える:Cr(OH)3+OH-→[Cr(OH)4]-
Cr(OH)3に過剰のNH3水溶液を加える:Cr(OH)3+6NH3→[Cr(NH3)6](OH)3
[Cr(OH)4]-の溶液に、酸化剤を加えて加熱すると、クロム酸イオン(CrO42-(黄色))が生成する。
2[Cr(OH)4]-+3H2O2+2OH-→2CrO42-+8H2O
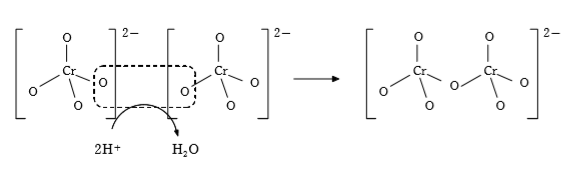
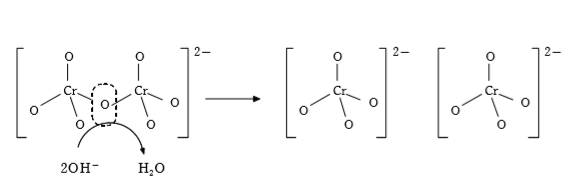
クロム酸イオン(CrO42-(黄色))の含まれる水溶液を酸性にすると二クロム酸イオン(Cr2O72-(赤橙色))が生じ、逆に、二クロム酸イオンが含まれる水溶液を塩基性にするとクロム酸イオンが生じる。
クロム酸イオンの含まれる水溶液を酸性にする:2CrO42-+2H+→Cr2O72-+H2O
二クロム酸イオンの含まれる水溶液を塩基性にする:Cr2O72-+2OH-→2CrO42-+H2O
また、クロム酸イオンは沈殿を作る力が強く、Pb2+、Ag+、Ba2+などと反応して沈殿を生じる。
Pb2++CrO42-→PbCrO4(黄色)
2Ag++CrO42-→Ag2CrO4(赤褐色)
Ba2++CrO42-→BaCrO4(黄色)
※二クロム酸イオンは沈殿を作らないが、二クロム酸イオンとクロム酸イオンは水中で次のような平衡状態にある。そのため、Pb2+、Ag+、Ba2+に二クロム酸イオンを含む水溶液を加えると、PbCrO4 、Ag2CrO4、BaCrO4などが沈殿する。
2CrO42-+H+⇔Cr2O72-+OH-
【Crの関連図と化学反応式】
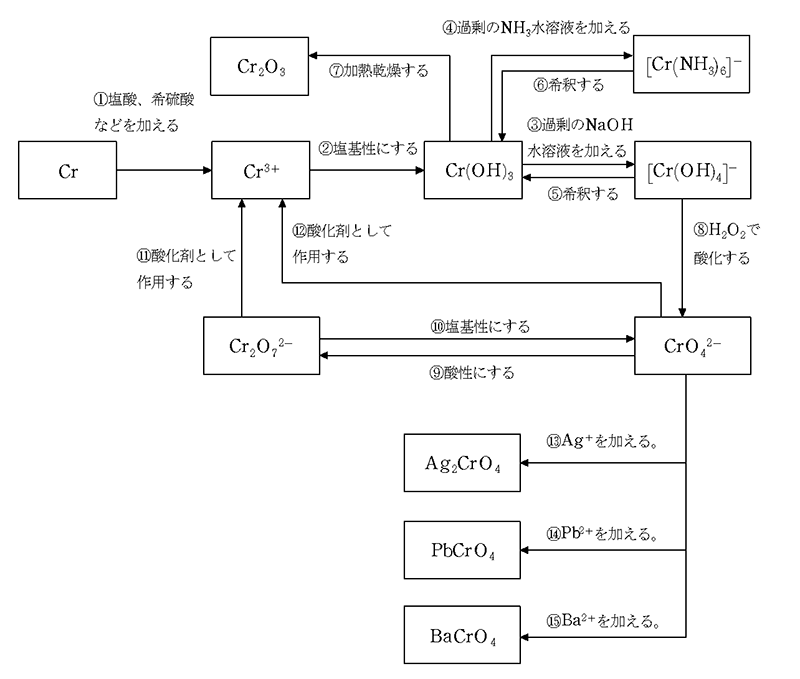
化学反応式
- ①2Cr+6HCl→2CrCl3+3H2
- ②Cr3++3OH-→Cr(OH)3
- ③Cr(OH)3+OH-→[Cr(OH)4]-
- ④Cr(OH)3+6NH3→[Cr(NH3)6](OH)3
- ⑤[Cr(OH)4]-→Cr(OH)3+OH-
- ⑥[Cr(NH3)6](OH)3→Cr(OH)3+6NH3
- ⑦2Cr(OH)3→Cr2O3+3H2O
- ⑧2[Cr(OH)4]-+3H2O2+2OH-→2CrO42-+8H2O
- ⑨2CrO42-+2H+→Cr2O72-+H2O
- ⑩Cr2O72-+2OH-→2CrO42-+H2O
- ⑪Cr2O72-+14 H++6e-→2Cr3++7H2O
- ⑫CrO42-+8H+ +3e-→Cr3++4H2O
- ⑬2Ag++CrO42-→Ag2CrO4
- ⑭Pb2++CrO42-→PbCrO4
- ⑮Ba2++CrO42-→BaCrO4
マンガン
マンガンの性質
マンガンは灰色の金属で、硬いが脆い金属である。マンガンはイオン化傾向が大きく、空気中で容易に酸化されて酸化物となる。+Ⅱ、+Ⅳ、+Ⅶの酸化数を取り、クロム同様酸化物は酸化剤として用いられる。
特に+Ⅶの過マンガン酸イオン(MnO4-(赤紫色))は酸性溶液中で非常に強い酸化力を示しMn2+(無色)となる
MnO4-+8H++5e-→Mn2++ 4H2O
※MnO4-やCr2O72-を酸化剤として用いるとき、溶液を酸性にするのに硫酸を用いる。
このとき、硫酸の代わりに硝酸や塩酸を用いてはならない。なぜならば、硝酸は酸化剤として、塩酸は還元剤として反応してしまうからである。
過マンガン酸イオンは中性や塩基性でも酸化力を持つが、その働きは酸性の時に比べて弱くなる。
MnO4-+2H2O+3e-→MnO2 +4OH-
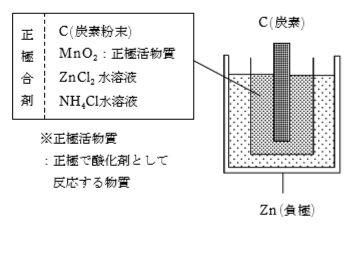
酸化マンガン(Ⅳ)は、黒褐色の粉末で水に溶けず、乾電池の正極活物質として用いられる。
正極での反応:MnO2+H2O+e-→MnO(OH)+OH-
負極での反応:Zn→Zn2++2e-
正極での反応によって生じたOH-により、次の反応が起こってNH3が生じる
NH4++OH-→NH3+H2O
生じたNH3は負極での反応で生じたZn2+と錯イオンを作り、安定する。
水銀
水銀の性質
水銀は常温で唯一の液体の金属である。多くの金属と合金を作りやすい。水銀と他の金属の合金をアマルガムという。
水銀の化合物には+Ⅰのものと+Ⅱのものがあるが、それぞれ性質が異なる。
例えば、Hg+の塩素化合物とHg2+の性質は下の表に示すように全く異なる。
| 塩化水銀(Ⅰ)Hg2Cl2:甘コウ | 塩化水銀(Ⅱ)HgCl2:昇コウ | |
|---|---|---|
| 水溶性 | 水に溶けにくい | 水に溶けやすい |
| 毒性 | 毒性なし | 毒性あり |
このように、同じ塩化水銀でも水溶性が異なるため、Hg+を含む水溶液にHClを加えると白色のHg2Cl2が沈殿するが、Hg2+を含む水溶液にHClを加えても沈殿は生じない。
Hg22++2Cl-→Hg2Cl2
※Hg+ではなく、Hg22+という形になるのは、Hg+は不対電子を持つため、2Hg22+という形になった方が安定だからである。
Hg2+を含む水溶液にNaOHを加えると、HgOの黄色沈殿が生じる。
HgOは不安定なため、加熱すると酸素を発生してHgに分解する。
Hg2++2OH-→HgO+H2O
2HgO→2Hg+O2
Hg2+を含む水溶液にH2Sを通じると、黒色の硫化水銀(Ⅱ)が生じる。
Hg2++S2-→HgS
※HgS は結晶構造によって色が変化する。上記の反応で得られたHgSはβ‐HgSと呼ばれ、黒色であるが、これを昇華して気体にした後に凝縮して得られるHgSはα‐HgSと呼ばれ、赤色である。自然界に生じるHgSもα‐HgSで、これを主成分とする鉱物は辰砂や丹(に)と呼ばれ、朱色の塗料として用いられた。現代でも朱墨や朱肉などに用いられる。





















































