無機化学
第14回 遷移元素④(Co,Ni,Ti)
コバルト
コバルトの性質
原子番号27の遷移元素で、 Co2+ と Co3+ の二種類のイオンが存在する。鉄より酸化されにくい性質を持つ。大学入試では性質を問われることはまずないが、6配位型の錯イオンの幾何異性体が難関大学で出題されることがある。
従って、ここではコバルトの性質を深く掘り下げず、錯イオンの幾何異性体についてのみ解説する。
錯イオンの幾何異性体
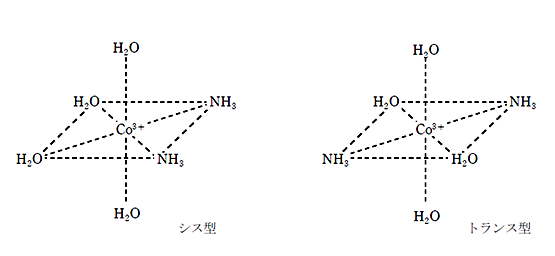
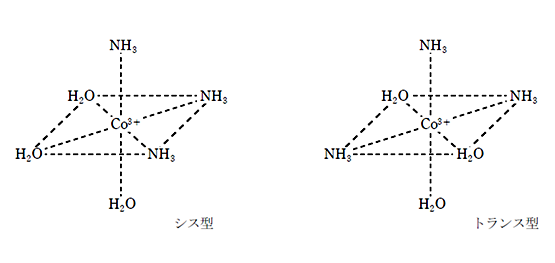
錯イオンのシス型とトランス型を書きなさい。という問題が出題されるので、下記の構造はしっかりと理解し、書けるようにしておこう。
① [ Co ( NH3 ) 2 ( H2O )4]3+ の幾何異性体
② [ Co ( NH3 ) 3 ( H2O )3]3+ の幾何異性体
ニッケル
ニッケルの性質
銀白色の金属で、濃硝酸や濃硫酸を作用させると不動態を作り溶けない。塩酸や希硝酸には溶けて、水溶液中では2価の陽イオンとなり、水溶液の色は緑色になる。
Ni + 2HCl → Ni2+ + H2
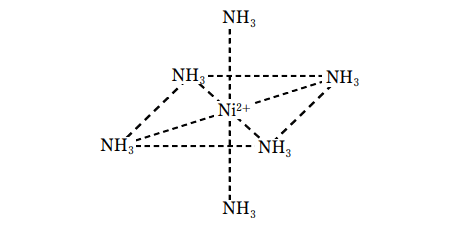
ニッケル陽イオンを含む水溶液に少量のアンモニアを加えると Ni ( OH )2の沈殿を作るが、多量に加えると錯イオンを作って溶解し、水溶液の色は青紫色になる。
Ni2+ + 2OH- → Ni ( OH )2
Ni ( OH )2 + 6NH3 → [Ni ( NH3 )6] ( OH )2
また、多くの合金を作り、銅との合金は白銀、鉄との合金はステンレスである。また、光沢があり、薬品に侵されにくいため、装飾用のメッキなどに用いられることもある。
ニッケル‐カドミウム電池
ニッケル‐カドミウム電池は正極活物質に酸化水酸化ニッケル、負極活物質にカドミウムを用いた電池で、起電力は1.2 (V)、繰り返し充電の可能な二次電池である。
カドミウムが環境を汚染する、電圧がマンガン電池やアルカリマンガン電池より低いことなどのデメリットがありますが、放電しきる直前まで電圧を一定に保てるなど、電圧を一定に保つ必要のある機器を動かすのに適している。
【正極】 NiOOH + H2O + e- → Ni ( OH )2 + OH-
【負極】 Cd + 2OH- → Cd ( OH )2 + 2e-
EDTA(エチレンジアミン四酢酸)滴定
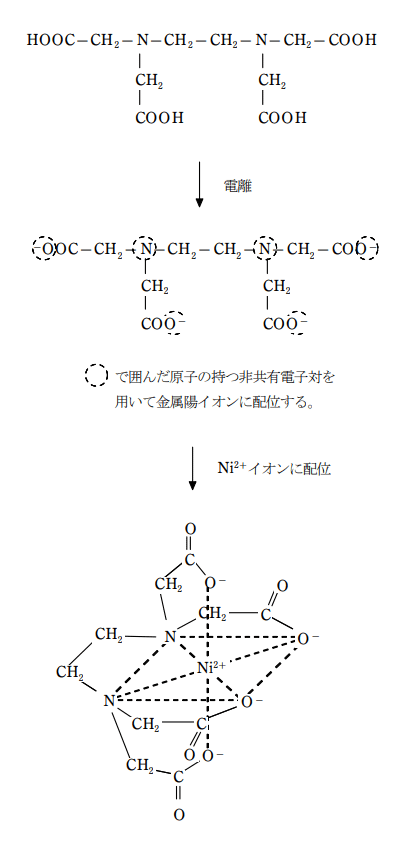
エチレンジアミン四酢酸は右図のような構造式を持つ有機化合物で、2つの窒素原子および4つのカルボキシ基の持つ非共有電子対により金属イオンに配位する。
EDTAが配位する力は非常に強く、Ni2+ Ca2+、Mg2+など、配位数6までの金属イオンに強く配位する。
このことを用いて、水溶液中の金属イオンの濃度を求めることができる。
エリオクロムブラックT( BT または EBT と表記)という試薬は、Ca2+やMg2+のような金属イオンと結びついて赤紫色を呈色するが、EDTA は、これらの金属イオンと BT 以上の強さで結びつく。 BT は金属イオンから離れると、青色を呈する。
そのため、最初に BT を過剰量加えて赤紫色に呈色させておき、そこにEDTA 水溶液を滴下して、青色に変色した点を当量点とすれば金属イオンの濃度を求めることができる。
例題)
【問題】
Ca2+が含まれた水溶液30mLに過剰量のBT 水溶液を加えたところ、赤紫色に呈色した。ここに0.10mol/LのEDTA水溶液を加えたところ、17.5mL加えたところで水溶液が青色になった。Ca2+ の濃度を求めよ。
【解答】
Ca2+ の濃度を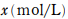 とすると、Ca2+の物質量:
とすると、Ca2+の物質量: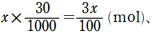
滴下したEDTAの物質量は 0.10 × 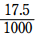 = 1.75 × 10-3(mol)
= 1.75 × 10-3(mol)
1つの Ca2+ に1分子の EDTA が配位するから 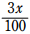 = 1.75 × 10-3
= 1.75 × 10-3
よって、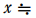 5.8 × 10-2(mol/L)
5.8 × 10-2(mol/L)
チタン
チタンの性質
強度、軽さ、耐食性、耐熱性にすぐれるが、精錬や加工が難しいため単体が大量に用いられることはあまりない。単体を用いた製品が実用化されたのは1950年代と使用され始めてまだそれほど時間が経過していないが、航空機、工場設備、建材、塗料、医療品など多くの用途に用いられている。
生体との親和性があり、骨と結合することができるので、人工関節や骨折した骨を接合するプレートなどとしても利用されている。
酸化物は非常に安定で薬品に侵されにくい不動態を作る。(大学入試では問われることはまずないが、Al、Fe、Ni、Cr以外にもこのように不動態を形成する金属は存在する。)TiO2 は白色塗料として昔から用いられているが、次に紹介するように1972年に光触媒としての性質が発見され、チタンそのものの性質が問われることはまずないが、応用例が多い金属であり、光触媒や水素吸蔵合金は一部の教科書にも登場していることから知っていた方が良いだろう。
光触媒
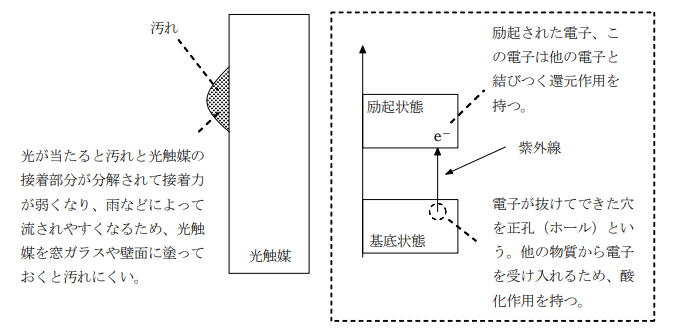
光を照射することにより触媒作用を示す物質の総称で、酸化チタン(TiO2) が代表的なものとして知られている。この物質は紫外線を吸収すると強い酸化還元作用と超親水作用を示し、それぞれ汚れや有害物質の除去を目的とした塗装、窓ガラスなどの撥水加工を目的としたコーティングなどに用いられている。
光触媒に紫外線を照射すると、電子が励起されて正孔(ホール:電子の抜けた穴)と励起された電子が生じる。正孔は接触している物質から電子を奪おうとし、励起された電子は接触している物質に移動して還元しようとする。そのため、光触媒の表面では酸化還元反応が同時におこり、付着している物質(汚れや有害物質など)を分解する。
形状記憶合金
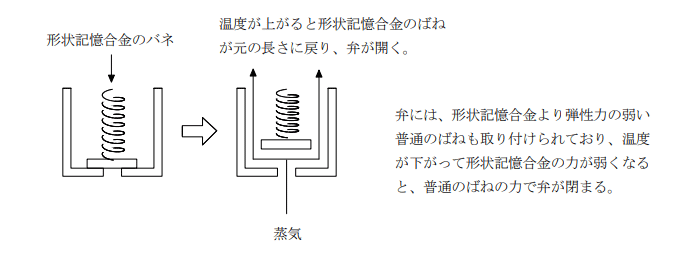
変形を加えても、一定温度以上に加熱すると元の形状を回復する性質を持つ金属を形状記憶合金という。形状記憶合金には様々な種類があるが、チタンとニッケルの合金が一般的である。
形状記憶合金の応用例の一つとして、炊飯器の圧力調整弁としての働きがある。
炊飯器を作動させて温度が一定以上になるとその熱で形状記憶合金で作られたバネが収縮して弁が開き、蒸気を外に逃がして内部の圧力が高くなりすぎないようにする。
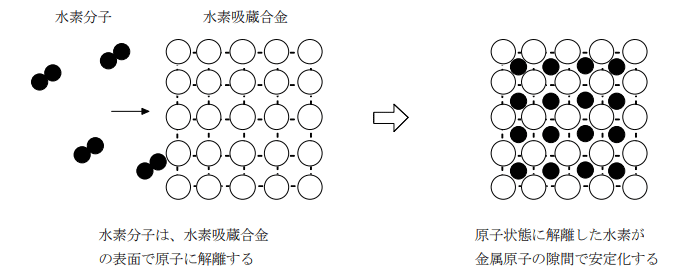
水素吸蔵合金
パラジウムやチタン、ニッケルなどの遷移金属元素やそれらの合金は、高圧で水素ガスを吹き付けると水素を取り込む性質を持つ。これは、結晶を構成する原子の間に水素原子が入り込んで安定化するためである。(結晶を構成する原子と水素原子が置換されて安定化するものもある。)
吸収するだけではなく、簡単に取り出すことができることも大切で、加熱や減圧などにより容易に取り出せるような合金が多数考案されている。
大学入試の問題では、水素吸蔵合金の構造が示され、その合金 M (g) に含まれる水素の物質量を求めよ。というような問題が出題されることがある。