無機化学
第16回 水素、窒素
水素
水素の性質
水素は第一族の第一周期に位置する元素である。最外殻電子数を1個持ち、単体は二原子分子である。1価の陽オンになりやすいが、H+はプロトンであり非常に不安定である。そのため、このイオンは通常、水溶液中で水に配位結合した状態で存在する。このイオンをオキソニウムイオンと呼ぶ。
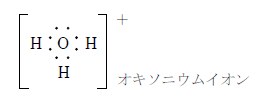
水素の単体は水に溶けにくい無色!無臭の気体で、全ての気体の中で最も密度が小さい。空気中で点火すると青白色の炎を上げて爆発的に燃焼する。
2H2 + O2 → 2H2O
水素は燃焼の際、二酸化炭素を排出しないことから環境に優しいエネルギーと考えられており、石油の代替エネルギーと考えられている。(水素を製造する際に二酸化炭素が出るが、自動車などでは放出された二酸化炭素を回収できないが、工場であれば回収することが可能である。)
水素の製法
①炭化水素の水蒸気改質
天然ガスやナフサなどの炭化水素にニッケル触媒存在下で水蒸気を作用させると一酸化炭素と水素を得ることができる。これを水蒸気改質といい、水素の工業的製法の一つである。
CH4 + H2O → CO + 3H2
C2H6 + 2H2O → 2CO + 5H2
②バイオマス水素
バイオマスとは、木くずや食品などの生ごみのことで、これを加熱やバクテリアの作用によって分解し、炭化水素や水素を得ることができる。入試問題としては化学反応の量的関係や熱化学の問題として出題されることがある。深く学ぶ必要はないが、こうした反応があるということは頭に入れておくとよいだろう。
| ガス化技術 | 技術概要 | 対象バイオマス |
|---|---|---|
| 高温ガス化 | 1000℃程度に加熱して熱分解して気体の炭化水素を得る。 | 木くず 草木など |
| メタン発酵 | 常温で嫌気的に発酵させ、メタンと二酸化炭素に分解する。 | 工場排水 食品廃棄物など |
| 超臨界水ガス化 | 超臨界水により、二酸化炭素、水素、メタンに分解する。 | 下水汚泥 食品廃棄物など |
| 水素発酵 | 常温で嫌気的に発酵させ、水素と二酸化炭素に分解する。 | 下水汚泥 食品廃棄物など |
③赤熱したコークスの水蒸気改質
赤熱したコークスに水蒸気を吹き付けると一酸化炭素と水素が発生する。
C + H2O → CO + H2
④亜鉛やアルミニウムと酸の反応
塩酸や希硫酸などの酸に亜鉛やアルミニウムなどの金属を加えると水素が発生する。
Zn + 2HCl → ZnCl2 + H2
水素の同位体
水素の同位体には、質量数1の軽水素、質量数2の重水素、質量数3の三重水素がある。重水素は核反応の際の中性子の減速に使用され、三重水素は核融合燃料などに用いられる。
高校で水素原子という場合、通常は質量数1の軽水素原子のことを指す。
窒素
窒素の性質
窒素は、空気中に約 80 %含まれる、無色無臭の気体である。化学的に安定で反応性は低い。
単体は空気の分留のほか、亜硝酸アンモニウムの熱分解によって得られる。
NH4NO2 → N2 + 2H2O
窒素の化合物
①アンモニア
アンモニアは刺激臭で無色の空気より軽い気体で、水に溶けて弱い塩基性を示す。高校の範囲では唯一の塩基性の気体である。このため、気体で塩基であればアンモニアであると考えてよい。
アンモニアと酸が反応するとアンモニウム塩が生じる。アンモニウム塩は非金属元素のみで構成されるがイオン性化合物であることに注意しよう。(他のイオン性化合物は金属元素と非金属元素の組み合わせである。)
アンモニアと塩化水素の反応 NH3 + HCl → NH4Cl
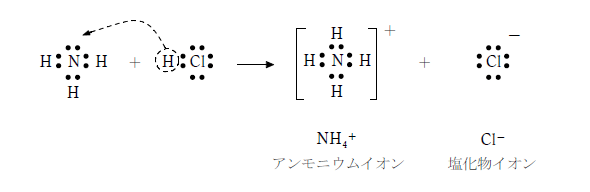
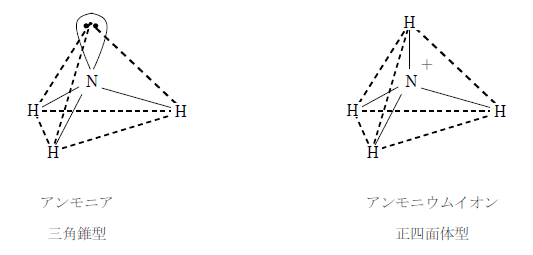
アンモニア分子は窒素に非共有電子対を持ち、酸が放出する水素イオンと配位結合してアンモニウムイオンとなる。アンモニア分子は三角錐型だが、アンモニウムイオンは水素イオンを受け取って正四面体型となる。
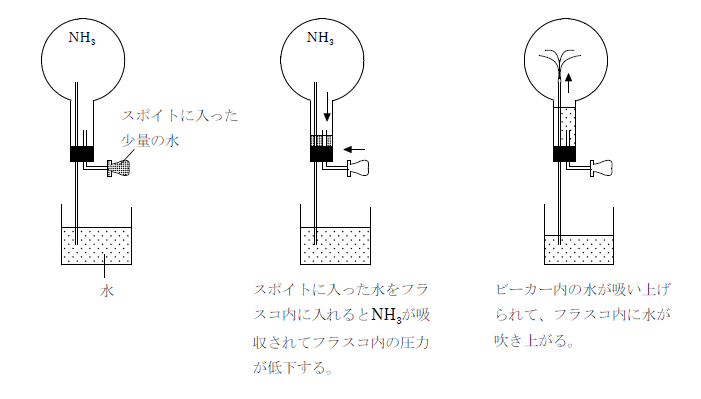
アンモニアは水への溶解度が非常に大きい。その性質を利用した下図のようなアンモニアの噴水実験が有名である。
アンモニアに高温で CO2 を作用させると、尿素が生じる。
2NH3 + CO2 → (NH2)2CO + H2O
アンモニアの検出方法
アンモニアの検出方法には以下の二つがある。
1)濃アンモニア水のびんに先端に濃塩酸をつけたガラス棒を近づけると、空気中で反応が起こって塩化アンモニウムが生じ、白煙となって見える。
NH3 + HCl → NH4Cl
2)アンモニアにネスラー試薬を加えると黄褐色の沈殿を生じる。
アンモニアの生成方法
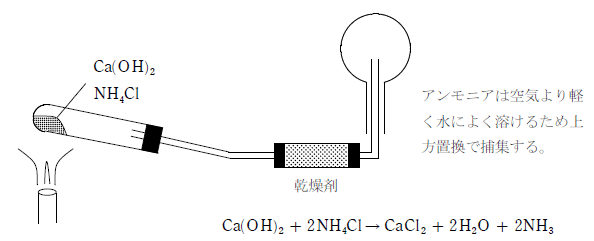
アンモニアは実験室においては、塩化アンモニウムと水酸化カルシウムの混合物を加熱して得られる。このとき、実験装置は下図のように試験管の口が下を向くようにしなければならない。これは、発生した水が加熱部分に触れて装置が壊れるのを防ぐためである。
また、乾燥剤に塩化カルシウムを用いてはならない。これは、塩化カルシウムにはアンモニアを吸収する働きがあるためである。
工業的には窒素と水素を Fe3O4 を触媒として用いて 450~500℃、200~300気圧で直接反応させて得られる。この方法はドイツで発明され、発明者の名前を取ってハーバー ・ボッシュ法と呼ばれる。
この反応の熱化学方程式は N2 + 3H2 = 2NH3 + 92.2kJ と表せる。
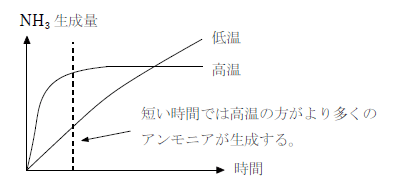
この反応は発熱反応で、生成物側で分子数が減るため、平衡状態でより多くのアンモニアを得るためには低温、高圧で反応させるべきである。しかし実際には高温で反応させる。これは、温度が高いほど反応速度が速いためで、平衡状態になるまで待たずに途中で反応を止めてアンモニアを回収し、それを繰り返す方が効率が良いのである。
②窒素酸化物
窒素の酸化物は一酸化窒素、二酸化窒素、四酸化二窒素、五酸化二窒素が存在する。性質を問われやすいのは一酸化窒素と二酸化窒素である。四酸化二窒素、五酸化二窒素は化学平衡の問題として出題されることが多い。
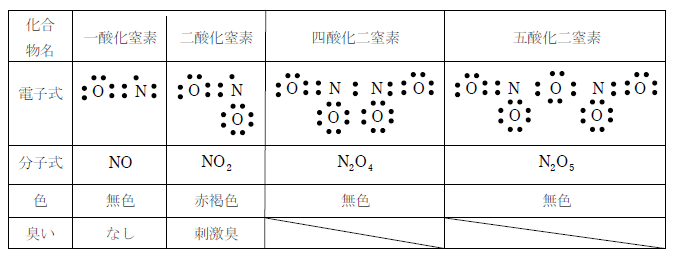
1)一酸化窒素
無色、無臭の気体で水と反応しない。不安定で空気中で容易に酸化されて二酸化窒素となる。
希硝酸と銅や銀が反応した際に生じる。
2)二酸化窒素
赤褐色、刺激臭の有毒な気体で、水と反応して硝酸と一酸化窒素を生じる。
3NO2 + H2O → 2HNO3 + NO
上表の電子式を見るとわかるように、窒素原子に結びついている2つの酸素原子は、一方が単結合、もう一方が二重結合である。しかし、実際は共に単結合と二重結合の間の1.5重結合になっていることが分っている。
これについて詳しく説明しよう。
共鳴構造による考え方
中心の窒素原子に結びつく2つの酸素原子は等価なので、実際は二重結合と配位結合がきわめて短い間で入れ替わっていると考えられる。
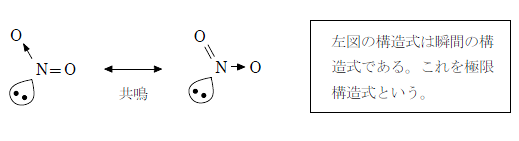
この入れ替わりの速度は非常に速く、実際は下図に示すように窒素原子と酸素原子の結合は単結合と二重結合の中間程度(1.5重結合)になる。
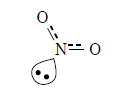
π 電子の非局在化による考え方
中心の窒素原子と2つの酸素原子がそれぞれ sp2 混成軌道を形成することで、3つのp軌道が全てつながって、そこに 6つの電子が共有される。これにより、窒素原子と酸素原子の間に存在する電子は平均3個となり、結合 は1.5重結合となる。
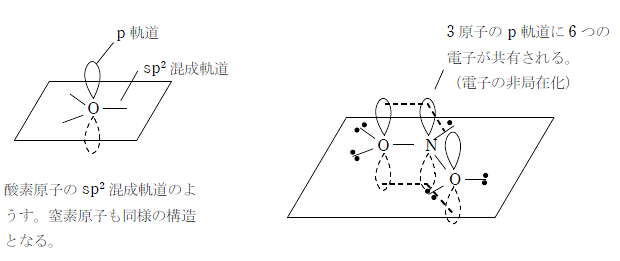
このように電子の偏りがなくなることで二酸化窒素は安定になる。これが、一酸化窒素と同様に非共有電子対を持ちながら二酸化窒素が一酸化窒素より安定な理由である。
3)四酸化二窒素
二酸化窒素の窒素原子が持つ不対電子が単結合して生じる物質である。色は無色で強い酸化力があり、ロケット燃料などに用いられる。
4)五酸化二窒素
四酸化二窒素の窒素原子の間に酸素原子が単結合して入り込んだ物質である。四酸化二窒素と同様に強い酸化力があり、ロケット燃料などに用いられる。
③硝酸
硝酸は酸化力のある酸で、Cu、Ag、Hgなどの金属を溶かすことができる。濃硝酸が作用した時は二酸化窒素、希硝酸が作用した時は一酸化窒素が生じる。
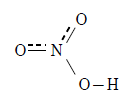
硝酸は下図のような構造を持つ。
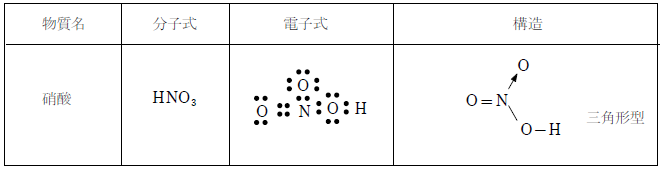
窒素原子に結合している3つの酸素原子のうち、水素を持たない2つは等価で、二酸化窒素と同様に結合が1.5重結合になっている。これを共鳴構造と電子の非局在化の両方で説明する。
共鳴構造による考え方
硝酸分子では、下図のように二重結合と配位結合がきわめて短い間で入れ替わり、下の2つの極限構造式をとると考えられる。
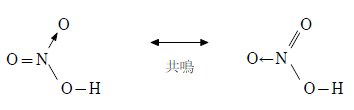
この入れ替わりの速度は非常に速く、実際は下図に示すように窒素原子と酸素原子の結合は単結合と二重結合の中間程度(1.5重結合)になる。
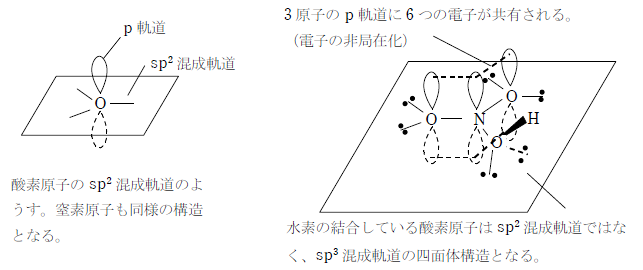
π 電子の非局在化による考え方
中心の窒素原子と2つの酸素原子がそれぞれ sp2混成軌道を形成することで、3つの p 軌道が全てつながって、そこに6つの電子が共有される。これにより、窒素原子と酸素原子の間に存在する電子は平均3個となり、結合 は1.5重結合となる。
銅と希硝酸の反応
半反応式)Cu → Cu2+ + 2e-
HNO3 + 3H+ + 3e- → NO + 2H2O
化学反応式)3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO2 + 4H2O
銀と濃硝酸の反応
半反応式)Ag → Ag+ + e-
HNO3 + H+ + e- → NO2 + H2O
化学反応式)Ag + 2HNO3 → AgNO3 + NO2 + H2O
※ Au、Pt は硝酸で溶かすことができない。これらの金属は濃硝酸と濃塩酸と混合物である王水によって溶かすことができる。
一方、Al、Fe、Ni、Cr、Co は濃硝酸により表面にち密な酸化被膜を形成して安定な状態となるため濃硝酸には溶けない。この状態を不動態という。希硝酸はこれらの金属も溶かすことができる。
硝酸は光や熱によって下記の反応を起こして分解するため、褐色ビンに入れて保存する。
4HNO3 → 4NO2 + 2H2O + O2
硝酸の検出
硝酸イオンや亜硝酸イオンを含む水溶液に FeSO4 を加えて濃硫酸を静かに入れると、濃硫酸と水溶液の境界面に褐色の輪が生じる。これは Fe2+ と NO の錯イオンであるが構造式は知らなくてよい。
硝酸の製法
1)オストワルト法
硝酸は工業的にはアンモニアを原料とする次のオストワルト法によって製造される。
アンモニアを白金を触媒に用いて酸化すると一酸化窒素が得られる。
4NH3 + 5O2 → 4NO + 6H2O
一酸化窒素を空気酸化すると二酸化窒素が得られる。
2NO + O2 → 2NO2
この二酸化窒素を水に吸収させると硝酸が得られる。
3NO2 + H2O → 2HNO3 + NO
2)揮発性の酸の遊離
実験室では、硝酸ナトリウムに濃硫酸を加えて加熱して作る。これは濃硫酸が不揮発性であるのに対し、硝酸が揮発性であることを利用した反応である。
NaNO3 + H2SO4 → NaHSO4 + HNO3





















































