無機化学
第15回 ハロゲン元素
ハロゲン元素
ハロゲン元素の性質
ハロゲン元素は周期表の第17族の元素で、価電子数が7のため、第一イオン化エネルギーが大きく、同じ周期では電子親和力が最も大きく、従って電気陰性度も非常に大きい。電子1つを受け取って1価の陰イオンになりやすい非金属元素である。
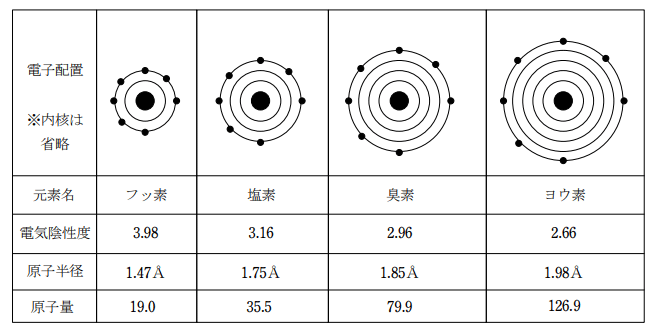
※:原子半径はファンデルワールス半径
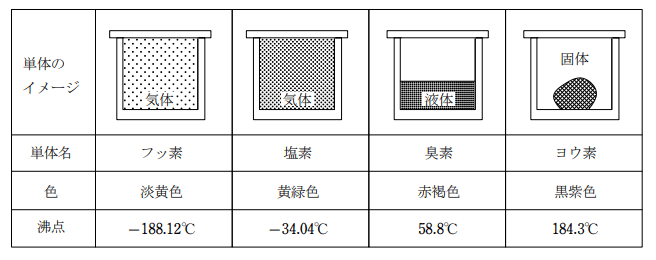
ハロゲン元素の単体
ハロゲン元素は単結合による2原子分子を作る。分子量が大きくなるにつれて沸点が高くなり、フッ素、塩素は常温常圧で気体だが、臭素は液体、ヨウ素は固体である。
分子間には弱い分子間力(ファンデルワールス力)しか働かないため沸点が低い。常温常圧で固体のヨウ素も結合が切れやすいため昇華する(室温でも昇華し、換気の良いところに置いておくと徐々に減少していく。)
ハロゲン元素の反応
ハロゲン元素は電子を奪う反応をしやすく、そのため単体は酸化力を持つ。周期の小さな元素ほど原子核と最外殻の距離が小さくなり、電子を引き付ける力が大きくなるため酸化力は周期の小さなものほど酸化力が強く激しい反応をする。
そのため、異なるハロゲン元素の単体と陰イオンが同士が反応する場合は、より周期の小さなハロゲン元素が陰イオンとなり、周期の大きな元素が単体となる。
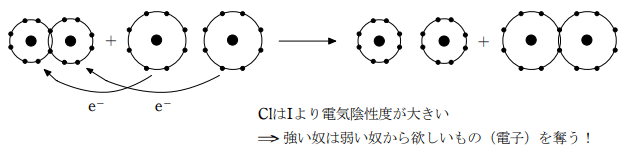
例1)ヨウ化カリウム水溶液に塩素を吹き込むと、ヨウ素が遊離して白濁する。
【反応式】 2KI + Cl2 → 2KCl + I2
これはヨウ素の電気陰性度は塩素の電気陰性度より小さいために Cl2 が I- から電子を奪う反応である。
例2)塩化水素水溶液に臭素を吹き込んでも、反応は起こらない。
これはヨウ素の電気陰性度は塩素の電気陰性度より小さいため、I2は Cl- から電子を奪うことができないためである。
このように、電気陰性度の大小を考えることで次の反応が自然に起こるかどうかを判別できる。
【自然に起こる反応】
① F2 + 2KBr → 2KF + Br2 (電気陰性度 F > Br)
② Br2 + 2HI → 2HBr + I2 (電気陰性度 Br > I )
【自然に起こらない反応】
① Cl2 + 2HF → 2HCl + F2 (電気陰性度 F > Cl )
② I2 + 2KBr → 2KI + Br2 (電気陰性度 Br > I )
フッ素
フッ素の性質
フッ素は刺激臭の淡黄色の有毒な気体である。
酸化力が非常に強く、酸化物イオンを酸化することもできる。したがって、水と反応すると O2 を発生する。
2F2 + 2H2O → 4HF + O2
また、金属や水素とも激しく反応する。水素とは冷暗所でも爆発的に反応して HF を発生する。
F2 + H2 → 2HF
フッ素の化合物
1)フッ化水素(HF)
フッ化水素は刺激臭の無色の有毒な気体である。他のハロゲン化水素と異なり、水に溶けると弱酸性を示す水溶液となる。フッ化水素の水溶液はフッ化水素酸という。
フッ化水素は、蛍石(CaF2)に濃硫酸を加えて加熱すると生じる。
CaF2 + H2SO4 → CaSO4 + 2HF ↑
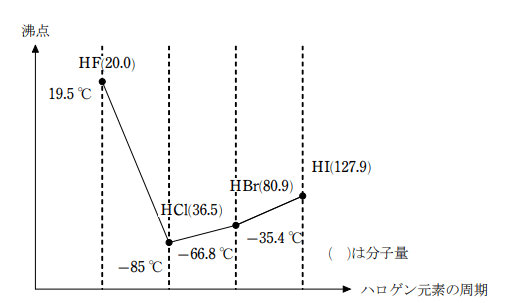
フッ化水素は沸点が他のハロゲン化水素よりも高く、20℃である。分子量が小さいにも関わらず沸点が高くなるのは、HFは分子間に水素結合を形成するからである。
フッ化水素が弱酸である理由も分子間に生じる水素結合のためである。フッ化水素では、H+ が電離するためにはフッ素原子との共有結合のほか、水素結合も切断しなくてはならず、電離しにくいのである。
フッ化水素の水素結合の様子
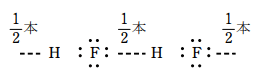
1分子当たり水素結合は1本
フッ化水素は、ガラスの主成分である SiO2 と反応するため、ガラスを溶かしてしまう。
そのため、ガラス瓶には保存できず、ポリエチレン容器に保存する。
※フッ化水素(気体)とフッ化水素の水溶液とでは反応が異なる。
フッ化水素(HF(気))とガラスの主成分の反応 : SiO2 + 4HF → SiF4 + 2H2O
フッ化水素酸(HF(aq))とガラスの主成分の反応 : SiO2 + 6HF → H2SiF6 + 2H2O
塩素
塩素の性質
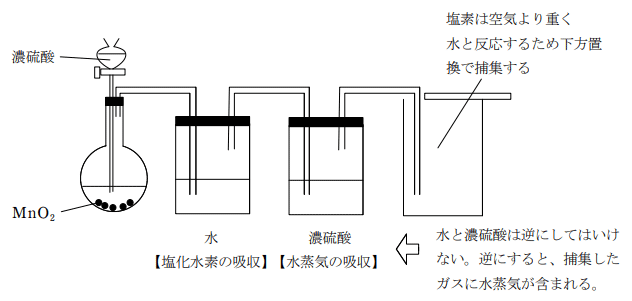
塩素は刺激臭の黄緑色の有毒な気体である。実験室ではさらし粉に希塩酸を加えるか、濃塩酸を酸化マンガン(Ⅳ)で酸化して得る。工業的には NaCl 水溶液の電気分解により得る。
① さらし粉に希塩酸を加えた場合の反応
CaCl (ClO)・H2O + 2HCl → CaCl2 + Cl2 + 2H2O
② 濃塩酸に酸化マンガン(Ⅳ)を加えた場合の反応
この反応では、加熱が必要である。また、酸化マンガンは酸化剤として働いている。過酸化水素の分解でも酸化マンガンを用いるが、こちらは触媒としてはたらいていることに注意しよう。
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
酸化力が強く殺菌漂白作用を示す。そのため、赤インキに塩素を吹き込んだり、塩素ガスの中に色づいた花びらなどを入れると色が消える。
水素や金属と激しく反応して塩化物を生じるが、酸素より電気陰性度が小さいためフッ素のように酸化物イオンを酸化することはできない。
塩素と水素は冷暗所では反応しないが紫外線などの強い光を当てると爆発的に反応する。光によって反応が進行するのは、塩素分子の共有結合が光によって切断されて反応性の高い塩素ラジカルが生じるためである。
Cl2 + H2 → 2HCl
※このように、塩素分子+光の組み合わせによって生じる塩素ラジカルによる反応はベンゼンへの付加反応など、かなり激しいものとなる。
塩素と銅は接触させただけではゆっくりとしか反応しないが、加熱した銅を塩素ガスの中に入れると激しく反応して塩化銅が生じる。
Cl2 + Cu → CuCl2
水と反応させると強酸性で酸化力を持つ水溶液となる。この水溶液は塩素水と呼ばれる。強酸性はHCl、酸化力は HClO によるものである。
Cl2 + H2O → HCl + HClO
塩素の化合物
①塩化水素
塩化水素は刺激臭の気体で、水溶液は強酸性を示し、塩酸と呼ばれる。塩化水素は揮発性の酸で、塩酸からは常に気体の塩化水素が発生している。
実験室では NaCl に濃硫酸を加えて加熱すると生じる。(揮発性の酸の遊離)この際、Na2SO4 ではなく NaHSO4 が生じることに注意しよう。
NaCl + H2SO4 → NaHSO4 + HCl
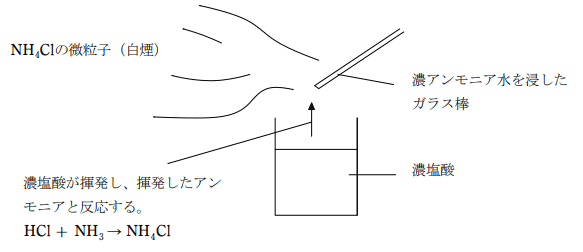
アンモニアと気体中で反応して白煙を生じる。これは NH4Cl の微粒子が生じるためである。
②塩素のオキソ酸
塩素のオキソ酸には、次亜塩素酸、亜塩素酸、塩素酸、過塩素酸などがある。
この中で最も出題されやすいのが次亜塩素酸である。次亜塩素酸は、塩素を水と反応させたときに生じる物質で酸化力があり、殺菌!漂白作用を示す。
塩素は電気陰性度が酸素より小さいため、HClOnの形をした分子中の塩素原子の酸化数は、必ずしも-1ではない。
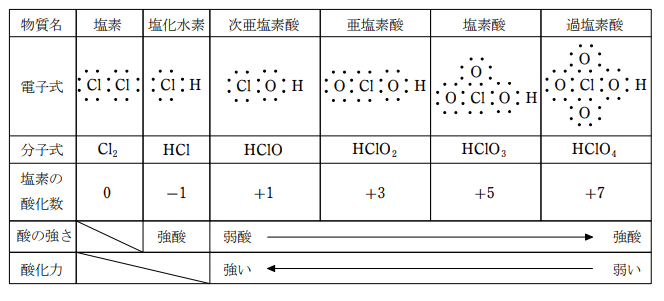
酸としての強さと酸化力について考察してみる。まず、酸化力であるが、これは、各分子の塩素原子の酸化数を比較すると理解できる。
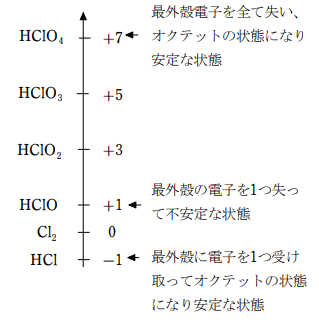
HClO4は酸化数が +7 であるが、このとき、Cl は最外殻電子を全て奪われた状態で Ne と同じ電子配置になり安定である。
一方、HClO は酸化数が +1 で、不安定な状態となっている。
このため、HClO は電子を受け取りやすい、すなわち、酸化力の強い物質となる。
次亜塩素酸の酸化剤としての半反応式
HClO + H+ + 2e- → Cl- + - H2O
次に、次亜塩素酸と過塩素酸の酸としての強さを比較する。
【分子内の電子の偏りのようす】

酸として強いというのは、電離して H+ が生じやすいということである。では、どのような分子で電離しやすいのかというと、それは、H との結合がイオン結合的である分子である。
過亜塩素酸では、H と結びついている O は結びついている Cl と H の両方から電子を奪うが、Clはこのほかに3つの O と結びついているため、これらにも電子を奪われており、H と結びついている O に多くの電子を供給することができない。
そのため、この O は結びついている H から多くの電子を奪う事となり、O ― H の共有結合はイオン結合的になって水溶液中で電離しやすくなる。その結果、過塩素酸は硫酸と同程度の強さの酸になる。
一方、次亜塩素酸では、O は Cl から多くの電子を供給されるため O ― H の共有結合は過塩素酸よイオン結合性が弱く、酸としての強さは弱い。
臭素とヨウ素
臭素の性質
臭素は非金属元素の単体で唯一、常温で液体の物質である。色は赤褐色で加熱すると容易に気体になる。ハロゲンなので酸化力があり、人体に有毒で取り扱いには注意が必要である。
臭素は炭素原子間に生じる不飽和結合に付加しやすく、反応によって色が消えることから不飽和結合の検出に用いられる。
ヨウ素の性質
ヨウ素は黒紫色の物質で、常温常圧で固体である。昇華性があり、液体を経ることなく固体の状態から気体となる性質を持つ。そのため、固体を放置しておくと気体となって徐々に減少する。
※ヨウ素は加熱すると113.7 ℃で融解して液体となる。昇華性があるだけで液体にならないわけではない。
昇華する速度は高温ほど速くなるため、下図のような実験装置を用いて昇華性のない物質(砂など)とヨウ素を分離することができる。
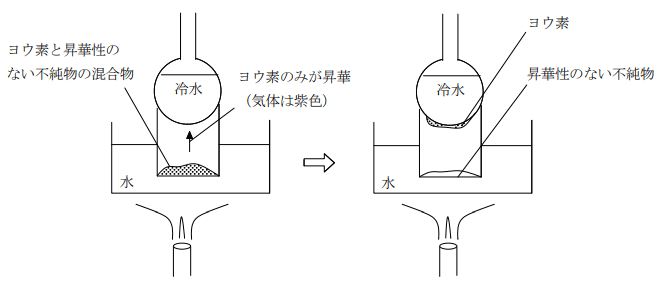
ヨウ素は水に溶けにくいが KI 水溶液には良く解け、赤褐色の水溶液となる。この水溶液をヨウ素ヨウ化カリウム水溶液(ヨウ素液)という。
これは、次の反応によりヨウ素分子が三ヨウ化物イオンになるためである。
I- + I2 → I3-





















































