理論化学
無機化学
第3回 錯イオン
今回は、錯イオンについて解説します。
1. 錯イオンとは
錯イオンは、金属イオンに分子やイオンなどが、自身が持っている非共有電子対を用いて配位結合することで生じます。配位結合される金属イオンを中心金属、配位結合する分子やイオンを配位子といいます。中心金属に結びつく配位子の数は決まっており、その数を配位数といいます。
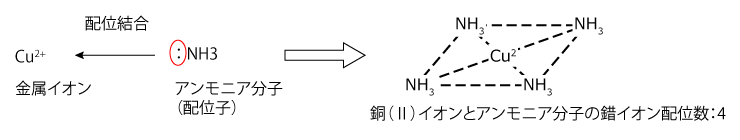
配位子には、下図のような種類があります。イオン名と配位子としての名称は異なるので注意してください。
| 配位子名称 | ヒドロキソ | シアノ | チオスルファト | アンミン | アクア |
|---|---|---|---|---|---|
| 配位子 | OH- | CN- | S2O3- | NH3 | H2O |
2. 錯イオンの名称と化学式
① 錯イオンの名称
錯イオンの名称は、次の順であらわします。
配位子の数・配位子の名称・中心金属・(中心金属イオンの価数)(錯イオンが陰イオンの場合【酸】を付ける。)・イオン
② 錯イオンの化学式の表し方
錯イオンの化学式は左図のように、角括弧の中に中心金属と配位子を書き、角括弧の右上に、価数を書いて表します。
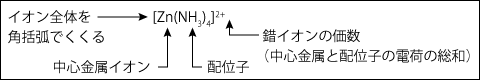
例として、次のイオンの名称と化学式を書いてみましょう。
例)亜鉛イオン ( Zn2+ ) を中心として、アンモニア分子 ( NH3 ) 4分子が配位したイオン
中心金属は亜鉛、配位子は NH3 ですから、アンミンです。亜鉛イオンが+2の電荷をもちアンモニア分子は電荷をもたないので、錯イオン全体の電荷は+2となります。なので、中心金属の価数の後ろの【酸】は必要ありません。そのことから、名称と化学式は次のようになります。
【名称】テトラアンミン亜鉛 (Ⅱ) イオン【化学式】 [Zn(NH3)4]2+例)亜鉛イオン ( Zn2+ ) を中心として、水酸化物イオン ( OH- ) 4つが配位したイオン
中心金属は、亜鉛、配位子は OH- ですから、ヒドロキソです。亜鉛イオンが+2の電荷をもち水酸化物イオンは-1の電荷をもっています。水酸化物イオンは4つあるので、錯イオンの電荷は-2となり、中心金属の価数の後ろに【酸】が必要です。
【名称】テトラヒドロキソ亜鉛 (Ⅱ) 酸イオン【化学式】 [Zn(OH)4]2-
3. 錯イオンを作る金属と配位子の組み合わせ、配位数、形状
錯イオンを作る金属と配位子の組み合わせや配位数、形状は決まっており、覚えなくてはいけません。ちょっと厄介なのですが、そんなに大したことはありません。頑張って覚えましょう。
① 中心金属によって配位する配位子が決まっている。
まず、中心金属と配位子の組み合わせを覚えましょう。
| ⅰ)OH- と錯イオンを形成する:Al3+、Zn2+、Sn2+、Pb2+、Cr3+ すべて両性元素です。【ゴロ】あ あ すん な りと くろ う しろ |
| ⅱ)NH3 と錯イオンを形成する:Cr3+、Ag+、Ni2+、Cu2+、Zn2+ 【ゴロ】くろ うした あげ く に どう しても あえん |
| ⅲ)CN- と錯イオンを形成する:Fe2+、Fe3+、Ag+ 【ゴロ】鉄 にい さん 銀歯だよ |
| ⅳ)S2O3- と錯イオンを形成する:Ag+ 【ゴロ】ありません。覚えてください。 |
② 中心金属によって配位する配位子の数が異なる。
中心金属に配位結合する配位子の数、つまり配位数は、中心金属の種類によって決まります。
| 配位数 2 | 配位数 4 | 配位数 6 |
|---|---|---|
| Ag+ | Al3+、Zn2+、Sn2+、Pb2+、Cu2+、Cr3+(OH- と錯イオンを作るとき) | Ni2+、Fe2+、Fe3+、Cr3+(NH3 と錯イオンを作るとき) |
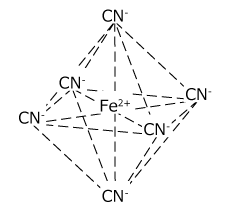
③ 配位数によって錯イオンの形状が異なる。
配位数 4の錯イオンのうち、Zn2+ だけが正四面体構造です。Zn2+ は両性元素で唯一 NH3 と錯イオンを作るなど、例外の多い金属なので問題として比較的出題されやすい元素です。
| 配位数2 | 配位数4 | 配位数6 |
| 直線 | Zn2+以外:四角形 Zn2+ :正四面体 | 正八面体 |
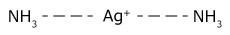 | 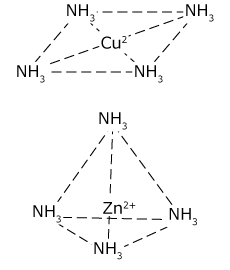 |  |
4. 具体的な錯イオン
ここまで出てきた錯イオンを、中心金属の種類ごとに書いて置きます。3. ルールを全部覚えていたら書けるはずですから、練習がてらやってみましょう。
① Al3+ の錯イオン → 配位子は OH-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| OH- | [Al(OH)4]- | テトラヒドロキソアルミン(Ⅲ)酸イオン |
※アルミニウムイオンではなく、アルミンになるので注意。
② Zn2+ の錯イオン → 配位子は OH-、NH3
| 配位子 | 化学式 | 名称 |
|---|---|---|
| OH- | [Zn(OH)4]2- | テトラヒドロキソ亜鉛(Ⅱ)酸イオン |
| NH3 | [Zn(NH3)4]2+ | テトラアンミン亜鉛(Ⅱ)イオン |
③ Sn2+ の錯イオン → 配位子は OH-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| OH- | [Sn(OH)4]2- | テトラヒドロキソスズ(Ⅱ)酸イオン |
④ Pb2+ の錯イオン → 配位子は OH-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| OH- | [Pb(OH)4]2- | テトラヒドロキソ鉛(Ⅱ)酸イオン |
⑤ Cr3+ の錯イオン → 配位子は OH-、NH3
| 配位子 | 化学式 | 名称 |
|---|---|---|
| OH- | [Cr(OH)4]- | テトラヒドロキソクロム(Ⅲ)酸イオン |
| NH3 | [Cr(NH3)6]3+ | ヘキサアンミンクロム(Ⅲ)イオン |
⑥ Ag+ の錯イオン → 配位子は NH3、CN-、S22-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| NH3 | [Ag(NH3)2]+ | ジアンミン銀(Ⅰ)イオン |
| CN- | [Ag(CN)2]- | ジシアノ銀(Ⅰ)酸イオン |
| S2O32- | [Ag(S2O3)2]3- | ビス(チオスルファト)銀(Ⅰ)酸イオン |
※S2 O32- はチオスルファトだが、ジチオスルファトは発音しにくいので、ジ、ではなくビスを用いる。また、チオスルファトは、チオとスルファとに分けることができるので、チオスルファトにビスが掛かっていることを明示するために(チオスルファト)と括弧を付ける。
⑦ Ni2+ の錯イオン → 配位子は NH3
| 配位子 | 化学式 | 名称 |
|---|---|---|
| NH3 | [Ni(NH3)6]2+ | ヘキサアンミンニッケル(Ⅱ)イオン |
⑧ Cu2+ の錯イオン → 配位子は NH3、H2O
| 配位子 | 化学式 | 名称 |
|---|---|---|
| NH3 | [Cu(NH3)4]2+ | テトラアンミン銅(Ⅱ)イオン |
| H2O | [Cu(H2O)4]2+ | テトラアクア銅(Ⅱ)イオン |
⑨ Fe2+ の錯イオン → 配位子は CN-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| CN- | [Fe(CN)6]4- | ヘキサシアノ鉄(Ⅱ)イオン |
⑩ Fe2+ の錯イオン → 配位子は CN-
| 配位子 | 化学式 | 名称 |
|---|---|---|
| CN- | [Fe(CN)6]3- | ヘキサシアノ鉄(Ⅲ)イオン |





















































