理論化学
無機化学
第9回 両性元素(Al)
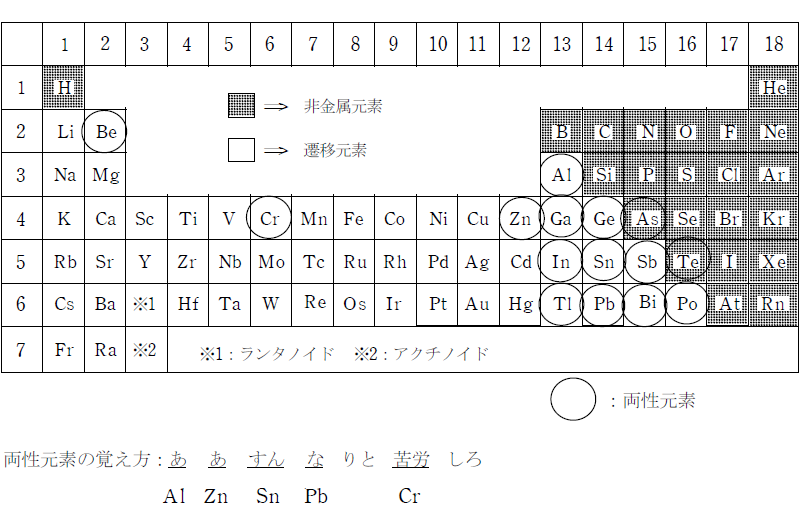
両性元素(Zn、Al、Sn、Pb)
両性元素とは、酸にも強塩基にも反応する金属のことである。主に周期表でアルミニウムの周辺に位置する15種類の金属を指す。 大学受験で重要になるのは、Zn , Al , Sn , Pb , Cr の5元素である。 このうち、Cr は遷移元素の単元で取り扱う。
両性元素を酸に反応させると水素を発生し、陽イオンになる。
Alに塩酸を加える:2Al+6HCl→2AlCl3+3H2↑
Znに塩酸を加える:Zn+2HCl→ZnCl2+H2↑
両性元素を強塩基に反応させると水素を発生し、錯イオンになる。
AlにNaOH水溶液を加える:2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
ZnにNaOH水溶液を加える:Zn+2NaOH+2H2O→Na2[Zn(OH)4]+H2↑
両性元素の酸化物や水酸化物も酸や強塩基と反応するため、両性酸化物、両性水酸化物と呼ばれる。
両性元素の酸化物や水酸化物に酸を反応させると陽イオンになる。
Al2O3 に塩酸を加える:Al2O3+6HCl→2AlCl3+3H2O
Al(OH)3に塩酸を加える:Al(OH)3+3HCl→AlCl3+3H2O
両性元素の酸化物や水酸化物に強塩基を反応させると錯イオンになる。
Al2O3にNaOH水溶液を加える:Al2O3+2NaOH+3H2O→2Na[Al(OH)4]
Al(OH)3にNaOH水溶液を加える:Al(OH)3+NaOH→Na[Al(OH)4]
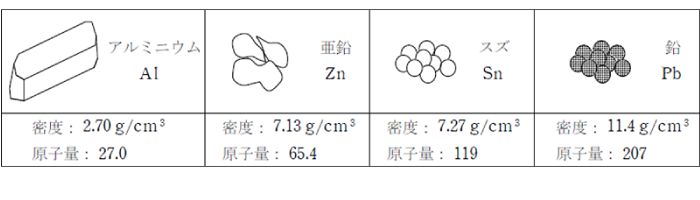
アルミニウム(Al)
単体は銀白色の軽金属で、軟らかくて展性や延性に富み、電気伝導性は銅に次いで大きい。
アルミニウムは両性元素で、酸にも塩基にも水素を発生して溶けるが、濃硝酸や濃硫酸には不動態となって溶けない。
塩酸との反応:2Al+6HCl→2AlCl3+3H2↑
NaOH水溶液との反応:2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
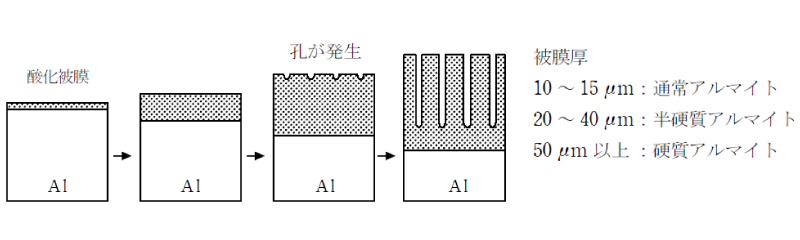
不動態とはAlの表面に緻密な酸化被膜(Al2O3) が生じた状態で、内部が保護されるため薬品等に侵されにくくなったものである。 人工的にAlの表面を不動態にしたものをアルマイトといい、市販のアルミニウム製品のほとんどはこのアルマイト処理を施してある。
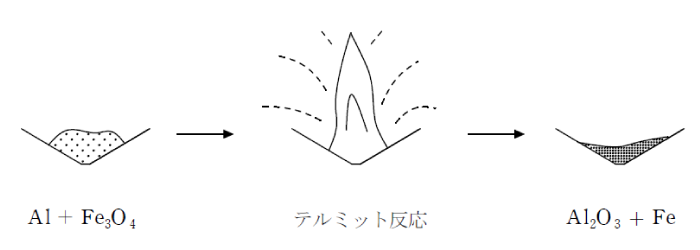
また、アルミニウムはイオン化傾向が大きく、酸化されやすい。そのため、Fe2O3 とアルミニウムの粉末を混合したものに点火すると、 アルミニウムがFe2O3 を還元する反応が起こり、激しい光と熱を発生して融解した鉄が生成する。この反応をテルミット反応という。 鉄道のレールの継ぎ目を溶接するのに用いられる。
テルミット反応:2Al+Fe2O3→Al2O3+2Fe
また、AlとCu、Mgとの合金をジュラルミンと呼び、軽く、非常に強いため航空機の機体や自動車部品などに用いられている。
アルミニウムイオンの反応
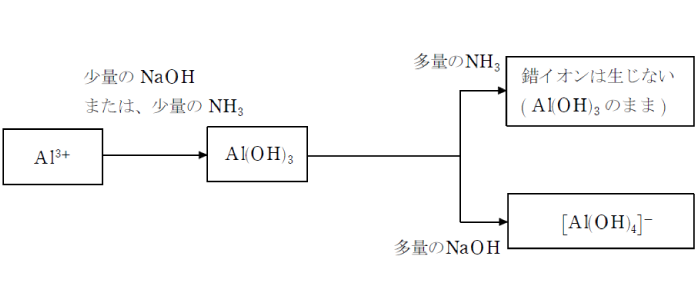
アルミニウムイオンを含む水溶液にNaOHやNH3 のようなアルカリを加えると、白色ゲル状の水酸化アルミニウム Al(OH)3が生じる。
Al3+3OH-→Al(OH)3
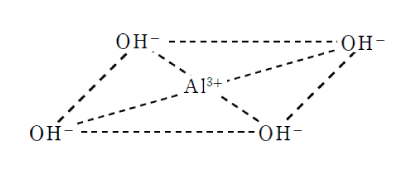
ここにNaOHを過剰に加えると、この沈殿は溶解する。これは、Al3+ が水酸化物イオンと錯イオンを作るためで、この錯イオンは正方形型をしている。
Al(OH)3+NaOH→Na[Al(OH)4]
また、Al(OH)3を加熱すると、脱水してAl2O3 となる。
2Al(OH)3→Al2O3+3H2O
ミョウバン
硫酸アルミニウムと硫酸カリウムの混合水溶液を冷却すると、無色透明で正八面体のミョウバン(硫酸カリウムアルミニウム十二水和物)が生じる。 ミョウバンは硫酸アルミニウムと硫酸カリウムが同じ割合で結合した物質で、水に溶解すると成分イオンに電離する。このような塩を複塩と言う。
AlK(SO4)2・12H2O→Al3+K++2SO42-+12H2O
ミョウバンの結晶を得るには、Al2(SO4)3とK2SO4の混合水溶液中にミョウバンの種結晶を入れ、冷却して静置する。
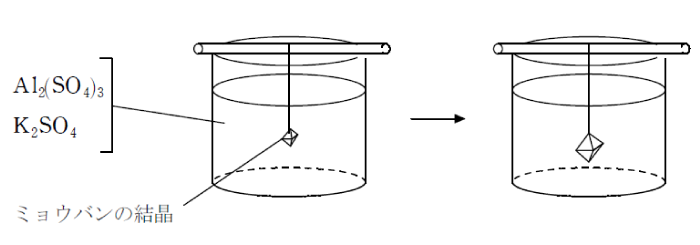
時間を置くと、ミョウバンの結晶が成長する。
酸化アルミニウム2 Al 3 O を主成分とする宝石をコランダムという。このコランダムにクロムが混入したものをルビーといい、鉄とニッケルが混入したものをサファイアという。
アルミニウムの製法
1)バイヤー法
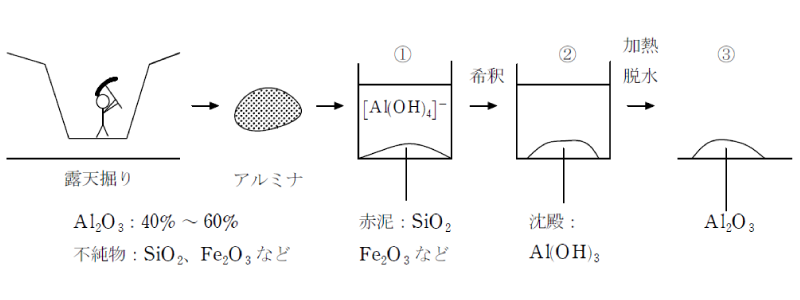
アルミニウムの原料鉱石であるボーキサイトは、不純物として二酸化ケイ素、酸化鉄(Ⅲ)を含む。ボーキサイトからアルミナを精製する工程は次のようになる。
①ボーキサイトを濃NaOH水溶液に加えて加熱すると、両性酸化物であるアルミナがヒドロキソ錯イオンとして溶解する。 この際、塩基性酸化物の酸化鉄と、酸性酸化物であるが結晶の強固なSiO2は溶解せずに沈殿する(赤泥)
Al2O3+2NaOH+3H2O→2Na[Al(OH)4]
②得られた溶液に水を加えて水酸化物イオン濃度を薄め、更に、水酸化アルミニウムの種結晶を加えると、種結晶を中心として水酸化アルミニウムの結晶が成長する。
Na[Al(OH)4]→NaOH+Al(OH)3
③水酸化アルミニウムの結晶を加熱すると、脱水が起こってアルミナが得られる。
2Al(OH)3→Al2O3+3H2O
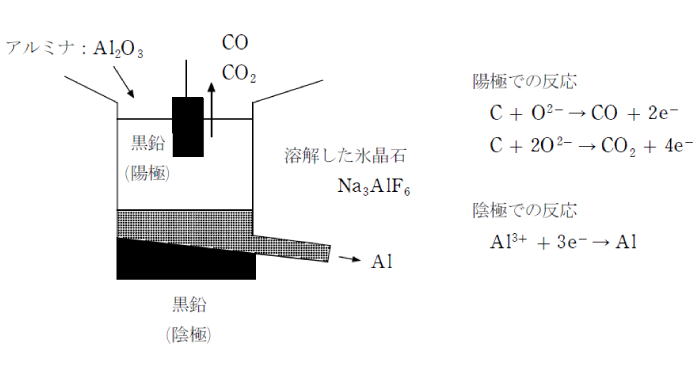
2)ホール・エルー法
バイヤー法によって得られたアルミナを氷晶石と共に融解すると、アルミナの融点(約2000℃)よりも低い温度(約1000℃)で融解液にすることができる。この融解液を炭素を電極として電気分解するとアルミニウムの単体が得られる。このようなアルミニウムの製法をアルミニウムの融解塩電解という。
このとき、陽極では一酸化炭素や二酸化炭素が発生し、陽極の炭素が減少する。
Al の関連図と化学反応式
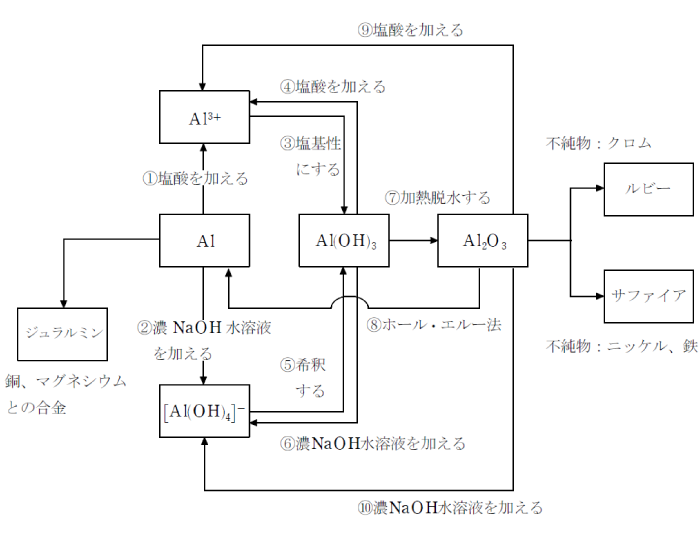
化学反応式
- ① 2Al+6HCl→2AlCl3+3H2↑
- ② 2Al+2NaOH+6H2O→2Na[Al(OH)4+3H2↑
- ③ Al3++3OH-→Al(OH3)
- ④ Al(OH)3+3HCl→AlCl3+3H2O
- ⑤ [Al(OH)4]-→Al(OH)3+OH-
- ⑥ Al(OH)3+NaOH→Na[Al(OH)4]
- ⑦ 2Al(OH)3→Al2O3+3H2O
- ⑧ Al3++3e-→Al
- ⑨ Al2O3+6HCl→2AlCl3+3H2O
- ⑩ Al2O3+2NaOH+3H2O→2Na[Al(OH)4]





















































