無機化学
第20回 硫黄
硫黄
硫黄の性質
硫黄は第十六族に属する原子量32.1の非金属元素で、最外電子殻に 6 個の電子をもち、2価の陰イオンになりやすい。
単体の固体は温度によって安定な同素体が異なり、1 気圧では 95.6℃ 以下では塊状結晶の斜方硫黄が安定、それ以上の温度では単斜硫黄が安定となる。115 ℃で融解して液体となり、さらに温度をあげると環状の分子が壊れ、 250℃ まで加熱すると 数十万個以上の硫黄原子が連なった高分子となる。この液体を冷水で急冷すると弾性を持つゴム状硫黄となる。ゴム状硫黄は純粋なものは黄色だが、不純物が混ざると褐色になる。ゴム状硫黄を室温で放置すると徐々に斜方硫黄に戻る。
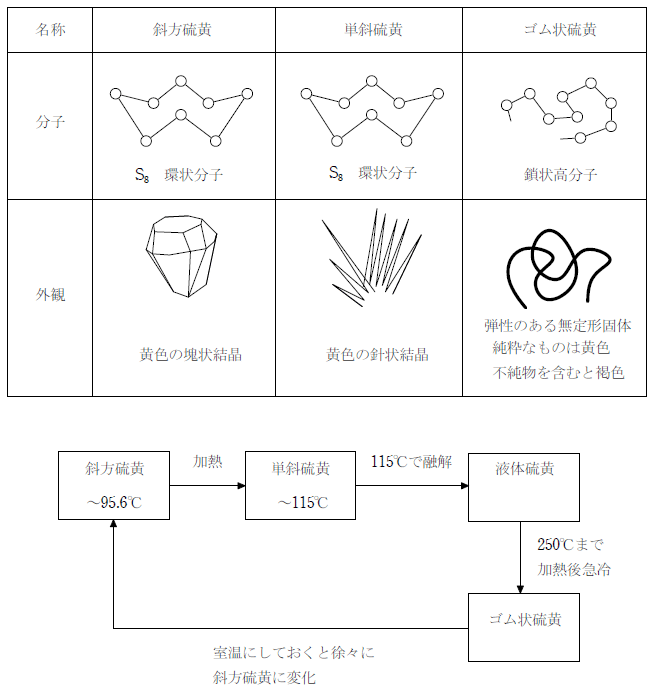
硫黄の化合物
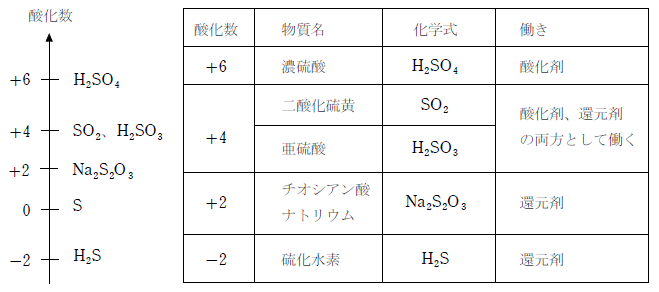
硫黄は複数の酸化数をとることができ、代表的なものとして酸化数が -2、0、+2、+4、+6 の化合物がある。このように複数の酸化数をとるため酸化剤や還元剤として働くが、それをまとめると次のようになる。
① 二酸化硫黄、亜硫酸
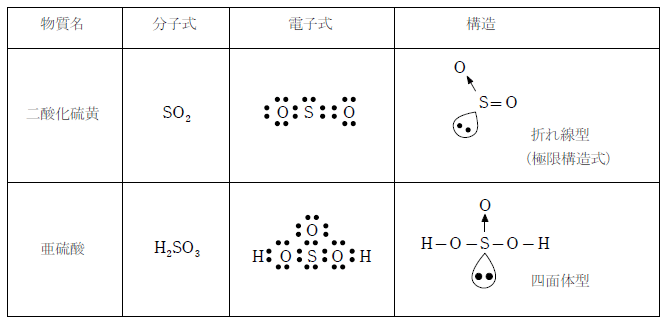
二酸化硫黄は下図に示すような電子式を持ち、結合している原子と非共有電子対の数の合計が3なので三角形型となる。電子対を無視すると折れ線型である(形状を問われたらこちらを答えるように)二重結合と単結合を1つずつ持つが、π電子が非局在化しており、オゾンと同様に、硫黄と酸素の間の結合は1.5重結合と考えられる。
※ 二酸化硫黄の1.5重結合について
二酸化硫黄には 2 つの酸素原子が結び付いている。各原子がオクテットを満たすように結合を考えると、上表のように二重結合と単結合(配位結合)が 1 つずつとなる。しかし、実際は二酸化硫黄はオゾンと同じように 1.5 重結合を持つ構造となっている。
共鳴構造による考え方
2つの酸素原子は等価なので、実際は二重結合と配位結合がきわめて短い時間で入れ替わっていると考えられる。
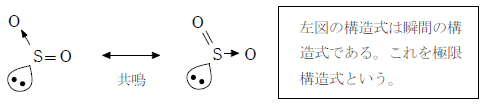
この入れ替わりの速度は非常に速く、実際は下図に示すように硫黄原子と酸素原子の結合は単結合と二重結合の中間程度(1.5重結合)になっていると考えられる。
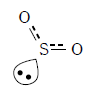
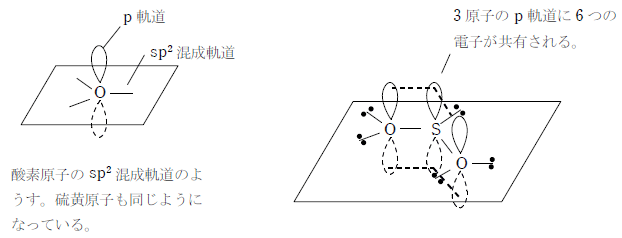
π電子の非局在化による考え方
酸素原子、硫黄原子がそれぞれsp2混成軌道を形成することで、2つの酸素原子と硫黄原子のp 軌道が結び付いて、ここに6つの電子が共有される。これにより、1つの酸素原子と硫黄原子の間に存在する電子は平均3個となり、酸素原子と硫黄原子の間の結合 は1.5重結合となる。
二酸化硫黄の性質
二酸化硫黄は無色、刺激臭の気体で、酸化力と還元力の両方を持つ。水と反応させると弱酸の亜硫酸となる。また、二酸化硫黄は酸化剤として反応する際、殺菌漂白作用を示す。この性質を利用して食品の漂白剤などとして用いられる。
【二酸化硫黄と水の反応】 NO2 + H2O → H2SO3
【二酸化硫黄の半反応式】
( 酸化剤として) SO2 + 4H+ + 4e- → S + 2H2O
( 還元剤として) SO2 + 2H2O → SO42- + 4H+ + 2e-
亜硫酸の性質
亜硫酸は 2 価の弱酸である。亜硫酸も二酸化硫黄と同様に酸化力と還元力の両方を持つ。また、亜硫酸や亜硫酸の塩に硫酸のような強酸を加えると二酸化硫黄の気体を生じる(弱酸の遊離)
【亜硫酸の半反応式】
( 酸化剤として) H2SO3 + 4H+ + 4e- → S + 3H2O
( 還元剤として) H2SO3 + H2O → SO42- + 4H+ + 2e-
【亜硫酸ナトリウムと硫酸の反応】 Na2SO3 + H2SO4 → Na2SO4 + SO2 +H2O
② 三酸化硫黄、硫酸
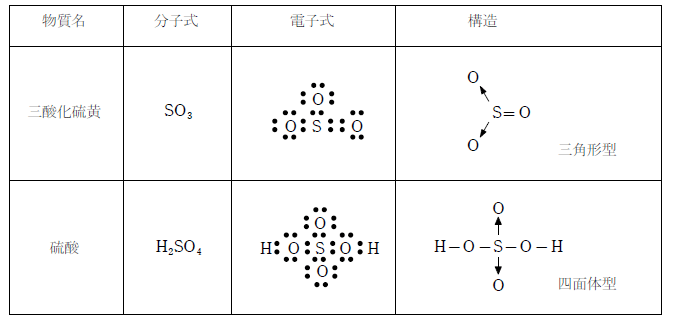
※三酸化硫黄の構造について
三酸化硫黄は、二酸化硫黄の硫黄原子が持つ非共有電子対に酸素が配位結合することで生じる。このとき、硫黄原子に結びついている 3つの酸素原子は等価なので、二酸化硫黄と同じように電子が非局在化して、1つあたりの結合は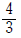 重結合となっている。
重結合となっている。
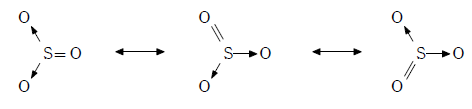
共鳴構造による考え方
三酸化硫黄の極限構造式は下図の3通りで、この3通りの構造をきわめて短い時間で絶え間なく行き来していると考えられる。このため、各結合は等価となり、1つあたり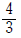 重結合と見積もることができる。
重結合と見積もることができる。
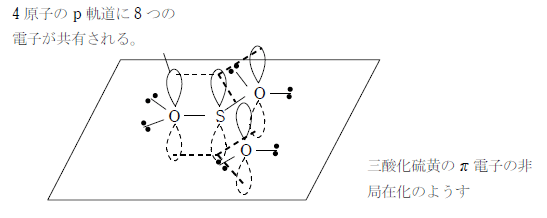
π電子の非局在化による考え方
三酸化硫黄は3つの酸素原子と1つの硫黄原子のp軌道が結び付き、ここに8つの電子が共有された構造を持つと考えられる。これにより電子の偏りが解消されて、単結合2つ、二重結合1つの状態より安定な構造になる。
三酸化硫黄の性質
三酸化硫黄は、水と反応すると硫酸となる物質で、酸性雨の原因物質の1つである。三酸化硫黄は酸化力と脱水作用があり、酸化剤として働くとSO2になる。
【三酸化硫黄の半反応式】SO3 + 2H+ + 2e- → SO2 + H2O
硫酸は不揮発性の強酸である。濃度によって性質が異なり、濃硫酸と希硫酸の性質の違いはしばしば出題される。
硫酸の性質
・希硫酸の性質
電離度が大きく、水溶液は強酸性である。H2よりイオン化傾向の大きな金属を酸化して溶解し、H2を生じる。
【Znと希硫酸の反応】 Zn + H2SO4 → ZnSO4 + H2
・濃硫酸の性質
電離度が小さく、水溶液は弱酸性である。SO42- による酸化力を示し、H2 よりイオン化傾向の小さな Cu、Hg、Ag を溶解することができる。この際、SO2 を生じる。しかし、Pt、Auを溶解することはできず、また、Al、Fe、Ni、Cr、Co は濃硫酸により表面に緻密な酸化被膜が生じるため溶解することができない(不動態)。
【Cuと濃硫酸の反応】
SO42-を酸化剤とする酸化還元反応なので、まず、半反応式を書く。
( SO42-の半反応式) SO42- + 4H+ + 2e- → SO2 + 2H2O
( Cu の半反応式) Cu → Cu2+ + 2e-
これを足し合わせて e- を消去すると、イオン反応式が得られる。
(イオン反応式) SO42- + 4H+ + Cu → Cu2+ + SO2 + 2H2O
H+ は H2SO4 によって供給されるので、両辺に SO42- を加えると全反応式が得られる。
(全反応式) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
濃硫酸は脱水作用があり、炭水化物などから H2O を奪って炭化する。また、エステル合成のような脱水反応の触媒や、発生させた気体乾燥剤として用いられることがある。
【グルコースに濃硫酸を作用させた時の反応(脱水作用)】
C6H12O6 → 6C + 6H2O
【ギ酸に濃硫酸を作用させたときの反応(脱水作用)】
HCOOH → H2O + CO
【シュウ酸に濃硫酸を作用させたときの反応(脱水作用)】
(COOH)2 → H2O + CO + CO2
また、濃硫酸の不揮発性を利用して、揮発性の強酸の塩から強酸を遊離させる次のような反応がある。どちらも硫酸ナトリウムではなく硫酸水素ナトリウムが生じることに注意しよう。
【塩化ナトリウムに濃硫酸を加え、加熱した時の反応】
NaCl + H2SO4 → NaHSO4 + HCl
【硝酸ナトリウムに濃硫酸を加え、加熱した時の反応】
NaNO3 + H2SO4 → NaHSO4 + HNO3
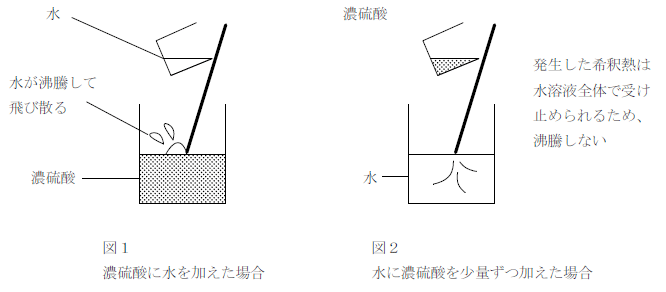
濃硫酸は希釈熱が大きく水より密度が大きい。そのため、濃硫酸を希釈するときに濃硫酸に水を加えると、下図1のように濃硫酸の上に水が浮き、生じた希釈熱で沸騰して飛び散ることがある。一方、下図2のように大量の水に濃硫酸を少しずつ加えていくと、生じた希釈熱は水全体に吸収されて急激に沸騰することはなく、比重の重い濃硫酸は水と混ざりながら沈むため安全である。
硫酸の製法
硫酸は工業的に非常に重要な酸で、次に述べる接触法で大量に作られている。
1)石油から分離した硫黄、または黄鉄鉱を燃焼させて SO2 を作る
【硫黄の燃焼】 S + O2 → SO2
【黄鉄鉱の燃焼】 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2) SO2 をV2O5 (五酸化二バナジウム)を触媒に用いて酸化し、SO3 を作る。
【二酸化硫黄の酸化】 2SO2 + O2 → 2SO3
3) SO3 を濃硫酸に吸収させて発煙硫酸とする。
ここで、水ではなく濃硫酸に吸収させるのは、SO3 の溶解熱が非常に大きいため、水に吸収させると沸騰して細かい希硫酸の粒子が生じてしまうためである。これを防ぐためには冷却しつつ高圧にする必要がある。一方、SO3 が濃硫酸に吸収されるときに生じる熱量は大きくないため、穏やかに溶液にすることができる。
4)発煙硫酸に希硫酸または水を加えて希釈し、目的の濃度の硫酸を得る
酸性の強さと硫酸と亜硫酸の酸性の違い
濃硫酸は弱酸で希硫酸は強酸であると勘違いしている人がいるが、これは誤りである。酸の強さは酸の解離定数 Kα によって決まり、これは酸の種類、溶媒の種類、温度によって決まる値で濃度が変わっても変化しない。したがって、濃硫酸も希硫酸も強酸である。
では、この勘違いは何によって生じているかというと、それは電離度の違いである。濃硫酸は電離した時に生じる水素イオン H+ を受け取る水分子が極めて少ないため電離度が大きくならない。この記述と高校化学では強酸を電離度1の酸と教えることによるものであろう。
多くの人が勘違いしていることのようなので注意してほしい。
次に、硫酸は強酸だが亜硫酸は弱酸となるのはなぜかについて定性的に解説する。これは次亜塩素酸と過塩素酸の違いと同じで、酸素と水素の結合のイオン結合性の差によるものである。
【硫酸】
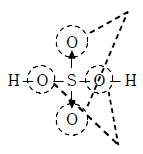
この 2 つの酸素原子が硫黄原子の持つ非共有電子対を強く引き付けるため、硫黄は電子が不足した状態となる。
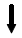
すると、この2つの酸素原子は硫黄原子から電子を多く受け取ることができず、水素原子から多くの電子を奪おうとする。そのため、O-Hの結合はイオン結合的になり電離しやすく、硫酸は強酸となる。
【亜硫酸】
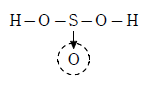
亜硫酸は硫黄原子に配位結合している酸素原子が1つだけなので、硫酸に比べて硫黄原子は電子を多く持っている。そのため、水素と結合している酸素原子は硫黄原子から電子を受け取ることができ、水素原子から奪う電子の量が硫酸より少なくて済む。
そのためO-Hの結合は共有結合的で電離しにくく、亜硫酸は弱酸となる。
③ 硫化水素
硫化水素は下図のような構造を持つ空気より重い気体で、腐卵臭を持つ。水に溶けやすく水溶液は弱い酸性を示す。火山ガスの1 つで人体に有毒である。
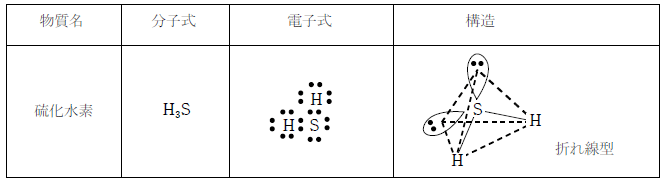
還元性を持ち、殺菌漂白作用を持つが、反応により硫黄の単体を生じるため漂白剤としては用いられない。
【硫化水素の半反応式】 H2S → S + 2H+ + 2e-
【硫化水素と二酸化硫黄の反応】 2H2 + SO2 → 3S + 2H2O
火山ガスとして自然に産出するほか、金属の硫化物に強酸を加えると得られる。
【硫化鉄に塩酸を加えた時の反応】 FeS + 2HCl → FeCl2 + H2S
④ チオ硫酸ナトリウム
チオ硫酸ナトリウム Na2S2O3 は、硫酸分子の酸素原子が1つ硫黄原子に置き換わったもので、ハロゲンの単体とよく反応するため、水道水中に含まれる塩素(カルキ)を除く用途に用いられる。また、還元力を持つため、ヨウ素滴定で利用される。ヨウ素以外のハロゲン単体と反応する場合と、ヨウ素と反応する場合では反応式が異なるため注意が必要である。
1)ヨウ素以外のハロゲン単体とは次のように反応する。
【塩素とチオ硫酸ナトリウムの反応】
Na2S2O3 + 4Cl2 + 5H2O → 2NaCl + 2H2SO4 + 6HCl
2)ヨウ素とは次のように反応する。
(ヨウ素の半反応式) I2 + 2e- → 2I-
(チオ硫酸イオンの半反応式) 2S2O32- → S4O62- + 2e-
(イオン反応式) I2 + 2S2O32- → 2I- + S4O62-
(全反応式) I2 + 2Na2S2O3 → 2NaI + Na2S4O6





















































