理論化学
化学講座 第29回:電気分解【ファラデーの法則】
今回は電気分解の定量的取り扱いについて説明します。電気分解も化学反応の一種ですから、化学反応式を立てて各物質の物質量を求め、比の式を作ればOKです。
しかし、このためには、電気量と電子の物質量の変換ができないといけません。
ファラデー定数
中学校で電流というものを習いましたよね。電流はA(アンペア)という単位で表されました。1Aというのは1秒当たり1Cの電気量が流れるという意味です。
さて、電子は1個あたり 1.60×10-19 C の電気量を持っています。(第1回参照)したがって、1mol の電子は1.60×10-19 × 6.02 × 1023 ≒ 96500 C の電気量を持っています。
この電子1molあたりの電気量F=96500(C/mol)はファラデー定数といいます。
これを使って、例題をいくつかやって見ましょう。
例題1)
- 0.1A の大きさの電流を、32分10 秒間流したとき、回路に流れた電子は何 mol か。
(解答)
電気量(C) = 電流(A) × 時間(秒)
電子の物質量(mol)=

まず、電気量を求めます。32分10 秒 = 1930 秒ですから、回路を流れた電気量は、
0.1 × 1930 = 193 C
よって、この回路を流れた電子は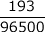 = 2.0 × 10-3 (mol)
= 2.0 × 10-3 (mol)
例題2)
- 電気分解の陽極で、2Cl- → Cl2 + 2e- の反応が起こるとき、回路に 0.2mol の電子が流れると、陽極で発生する Cl2 は何molか。
(解答)
-
反応式より、1mol の Cl2 が生じるのに必要な電子の物質量は 2mol であるから、陽極で発生する Cl2 の物質量を χ mol とすると、χ:0.2 = 1 : 2 が成立する。これを解いて、χ=0.1 mol
例題3)
- 電気分解の陰極で、Zn2+ + 2e- → Znの反応が起こるとき、陰極の質量が13g 増加した。Zn の原子量を65とするとき、この回路に流れた電子の物質量を求めよ。
(解答)
-
反応式より、1mol の Zn が析出するのに必要な電子の物質量は 2mol であるから、回路に流れた電子の物質量を χ molとすると、
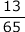 = 1 : 2 これを解いて、χ = 0.4 mol
= 1 : 2 これを解いて、χ = 0.4 mol
例題4)
- 電気分解の陽極で、2Cl- → Cl2 + 2e- の反応が起こるとき、0.1A の大きさの電流を32 分10秒間流した。このとき、陽極で発生する Cl2 は標準状態で何 L か。
(解答)
-
32分10秒は1930 秒である。この反応において、回路を流れた電子の物質量は、
0.1 × 1930 ÷ 96500 = 0.0020 mol である。
また、反応式より、1molの Cl2 が発生するのに、2mol の電子を必要とすることから、発生する Cl2 の標準状態での体積を VL とすると、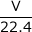 : 0.002 = 1 : 2 これを解いて、V = 0.224 L
: 0.002 = 1 : 2 これを解いて、V = 0.224 L





















































