理論化学
化学講座 第28回:電気分解【さまざまな電気分解】
② NaCl水溶液の電気分解(NaOH の製法、陽イオン交換膜法)
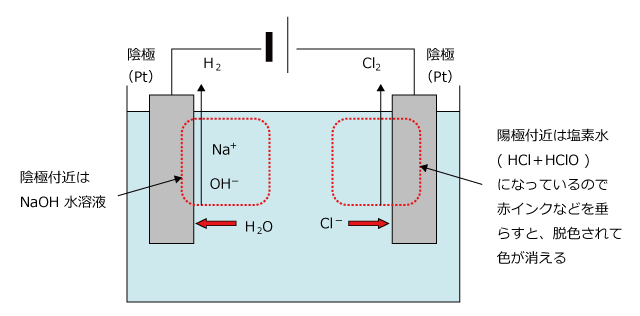
NaCl 水溶液の電気分解で、電極板に Pt を用いた場合に陽極と陰極で起こる反応を考えましょう。
| 陽極 : | 極板は Pt ですから、陽極板の溶解は起こらず、Cl-が酸化されてCl2が生じます。 |
| 2Cl- → Cl2 + 2e- | |
| 陰極 : | Na+は反応しませんから、H2O が還元されてH2が生じます。 |
| 2H2O + 2e- → H2↑ + 2OH- |
この反応で、陰極付近には OH-が発生します。また、Na+は陰極付近に引き付けられますから、陰極付近の水溶液は、電気分解が進行すると NaOH 水溶液になっていきます。
したがって、陰極付近の水溶液を濃縮すれば、NaOH を得ることができます。しかし、この方法では、NaCl も不純物として混ざってしまい、純度の低い NaOH しか得ることができません。
そこで、陰極と陽極の中央を陽イオンしか通さない、陽イオン交換膜で仕切り、陰極側には薄い NaOH 水溶液、陽極側に濃度の高い NaCl 水溶液を入れて電気分解することにします。
すると、陰極では H2O が反応して OH- が生じて溶液全体が負に帯電する一方で、陽極ではCl2が発生して陽イオンの Na+ が余り、溶液全体が正に帯電します。そこで、OH- が陰極側から陽極側へ、Na+ が陽極側から陰極側へ移動しようとしますが、陽イオン交換膜は陰イオンを通しませんから、陽極側から陰極側へ Na+ が移動するだけになります。
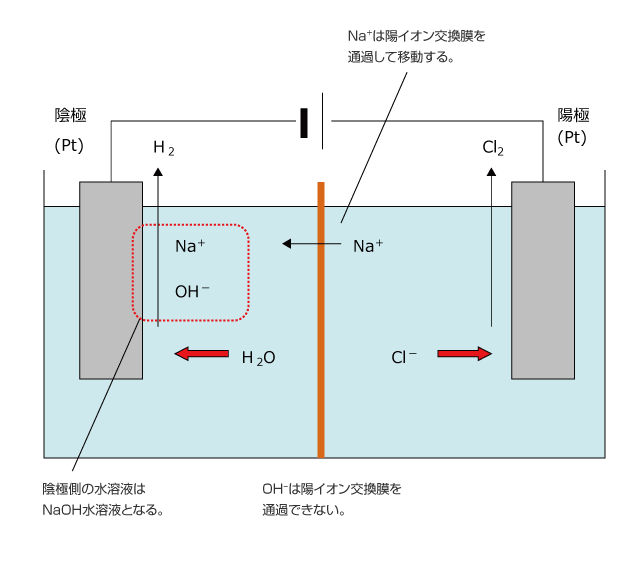
この方法を使えば、陰極側に純粋な NaOH 水溶液を得ることができます。この方法を陽イオン交換膜法といい、我が国の NaOH の生産は、全てこの方法で行われています。





















































