理論化学
化学講座 第21回:酸化と還元③「酸化剤と還元剤・酸化還元反応式」
酸化剤の一例
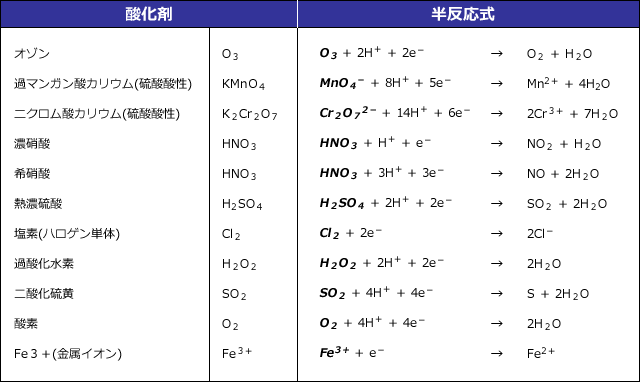
さて、この半反応式ですが、このまま暗記するのは大変ですよね。実は、酸化剤の半反応式は、反応前の物質と反応後の物質だけを覚えておけば、簡単に書く事ができるのです。
硫酸酸性過マンガン酸酸カリウムを例にとって説明します。
まず、反応の最初と最後だけは覚えておきます。

ここから、左辺と右辺の原子の数と電荷を調節していきます。
- 右辺に H2O を加えて両辺のOの数をそろえる。

- 右辺と左辺のHの数を合わせるために左辺に H+ を加える。

- 両辺の電荷がつりあうように左辺に e- を加える。(完成)
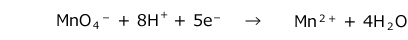
どうです?結構簡単ですよね。1~3の手順は、どの酸化剤でも同じです。
それと、気になっている人もいると思いますが、二クロム酸カリウムや過マンガン酸カリウムなどは硫酸酸性という条件が付いていますよね。
というのも、酸化剤の反応を見てもらうとわかりますが、どの反応もH+が左辺にありますね。つまり、酸化剤が反応するためには、H+が必要で、それを供給するために酸性にする必要があるのです。
では、なぜ硫酸でないといけないのかという疑問も生じますよね。実は、硫酸以外の塩酸や硝酸といった酸は、それ自身が酸化剤あるいは還元剤として反応してしまうため、滴定などで用いると、誤差の原因になってしまうからなのです。





















































