理論化学
化学講座 第18回:酸と塩基(5)
(解答・解説)
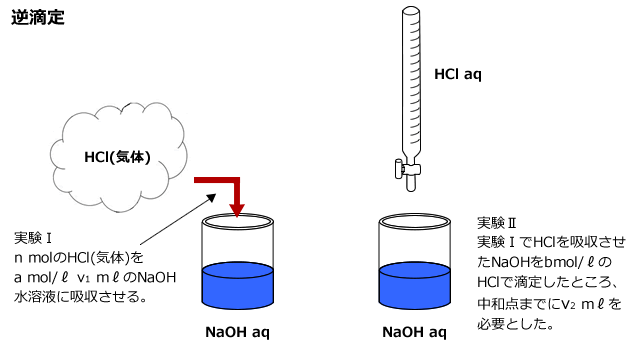
気体に含まれるHClの物質量をn molとおいて、まず、実験Iにおける中和反応を考えてみましょう。
実験Iでは、気体中に含まれるHCl と、水溶液に含まれるNaOHが下式で表される反応をします。
HCl + NaOH → NaCl + H2O ・・・・①
気体に含まれるHClの物質量はn mol 、水溶液に含まれるNaOHの物質量はa×![]() molです。
molです。
①式より、HClとNaOHは1:1の割合で反応しますから、a× ![]() - n molのNaOHが反応せずに残ります。
- n molのNaOHが反応せずに残ります。
次に、残ったNaOHを実験IIで滴定すると、b mol/ℓ のHClがv2mℓ 必要でした。
中和の公式【H+の物質量】=【OH-の物質量】より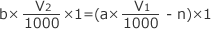 が成立します。
が成立します。
これを解くと、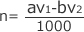 mol となり、HClの物質量がわかります。
mol となり、HClの物質量がわかります。
(解答・解説)
もう少し楽にやれる方法も紹介しておきます。
この実験は、a mol/ℓのNaOHaq v1mℓをのHClで二回に分けて中和していると考える事もできますよね。
すると、加えたH+の物質量とOH-の物質量は等しくなるはずです。
【H+の物質量】= n×1+b×![]() ×1 mol
×1 mol
【OH-の物質量】= a×![]() ×1 mol
×1 mol
【H+の物質量】=【OH-の物質量】よりn×1+b×![]() ×1=a×
×1=a×![]() ×1
×1
これを解くと、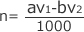 mol
mol
こちらのほうが楽ですよね。
逆滴定では【H+の物質量の総和】=【OH-の物質量の総和】を考えれば良いわけです。
ただし、途中で溶液の一部を取り出す操作がある問題ではこの方法は使えないので注意してくださいね。
次は、私大医学部入試でも頻出の二段滴定についてお話しします。





















































