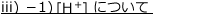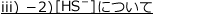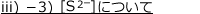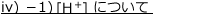理論化学
化学講座 第56回:化学反応速度⑦ 弱酸・弱塩基の電離
強酸や強塩基は電離度が1(本当は1ではないが、高校では1とみなす。)なので、![]() ≒酸の濃度×価数が成立します。そして、そこから水溶液のpHを求めるとができます。
≒酸の濃度×価数が成立します。そして、そこから水溶液のpHを求めるとができます。
しかし弱酸や弱塩基は電離度が1ではないので、これと同じように[![]() ]を求めることはできません。
]を求めることはできません。
弱酸や弱塩基は、それぞれ質量作用の法則を用いて[![]() ]を求めます。今回は、代表的な酸や塩基について、取り扱い方を説明していきますが、質量作用の法則を近似せずに解くのはものすごく大変で、事実上不可能です。
]を求めます。今回は、代表的な酸や塩基について、取り扱い方を説明していきますが、質量作用の法則を近似せずに解くのはものすごく大変で、事実上不可能です。
そこで、何らかの近似をする必要があります。近似のしかたには大きく分けて2種類あって。1つは質量作用の法則のみを利用するもので、もう1つは質量作用の法則+物質量保存則+電荷保存則まで利用する、すこし精密な取り扱い方です。まずは、質量作用の法則のみを使った考え方から説明します。出題の9割以上はこっちです。
⑴ 電離平衡の取り扱い⇒質量作用の法則+近似
i)1価の弱酸の電離:酢酸
1価の弱酸の例として、酢酸を取り上げてみましょう。
電離して生じた![]() は、
は、![]() と結びついて
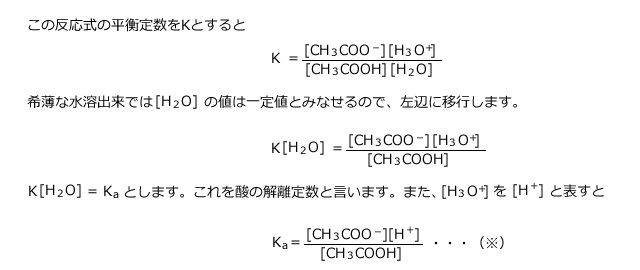
と結びついて![]() (オキソニウムイオン)となりますから、酢酸の電離の式は次のように表されます。
(オキソニウムイオン)となりますから、酢酸の電離の式は次のように表されます。

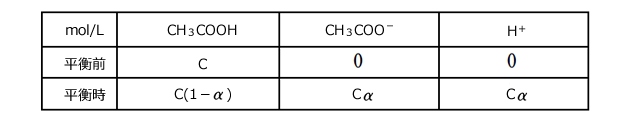
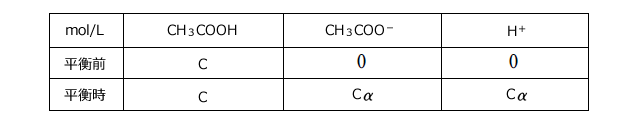
ここで、調製時の酢酸濃度をC(mol/L)、酢酸の電離度を![]() とすると、平衡時の各成分の濃度は下の表のようになります。
とすると、平衡時の各成分の濃度は下の表のようになります。
これを(※)に代入すると、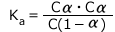 この式を
この式を![]() について解くと、
について解くと、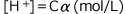 が求められます。
が求められます。
ここから2通りの解き方があります。
![]() の値が1と比べて十分小さいときは、1-
の値が1と比べて十分小さいときは、1-![]() ≒1とみなすことができます。
≒1とみなすことができます。![]() が十分小さいと問題文に書いてあるときは容赦なくこの近似を使っていいのですが、そうでないときも、いったんはこの近似を使います。
が十分小さいと問題文に書いてあるときは容赦なくこの近似を使っていいのですが、そうでないときも、いったんはこの近似を使います。
その結果得られた![]() の値が0.04より大きかった場合は、
の値が0.04より大きかった場合は、![]() は1より十分小さいとはいえず、1-
は1より十分小さいとはいえず、1-![]() ≒1とすることは出来ません。この場合は2)の方法で再度計算します。
≒1とすることは出来ません。この場合は2)の方法で再度計算します。
これを(※)に代入すると
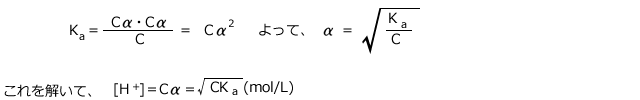
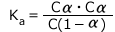 を
を![]() について解きます。
について解きます。

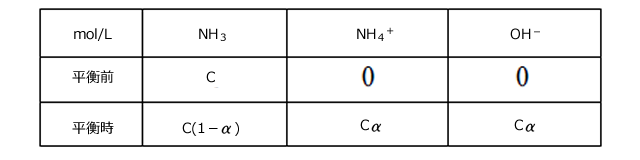
ii)1価の弱塩基の電離:アンモニア
アンモニアの電離の式は次のように表されます。
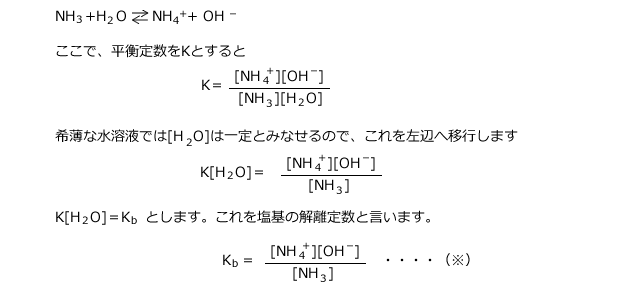
電離度を![]() とすると、各濃度は下表のようになります。
とすると、各濃度は下表のようになります。
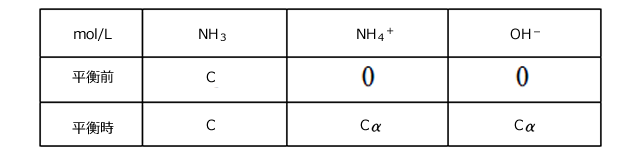
ここで![]() ≪1とすると、C(1-
≪1とすると、C(1-![]() )≒Cが成立しますね。
)≒Cが成立しますね。
iii)2価の弱酸の電離:硫化水素
2価の弱酸の例として硫化水素![]() について考えます。
について考えます。
![]() は次のような二段階の電離をします。
は次のような二段階の電離をします。
一段目の電離: 平衡定数
平衡定数 ![]() (mol/L)
(mol/L)
二段目の電離: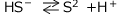 平衡定数
平衡定数 ![]() (mol/L)
(mol/L)
一段目の電離の式について、質量作用の法則より、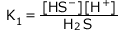 ・・・①
・・・①
二段目の電離の式について、質量作用の法則より、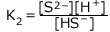 ・・・②
・・・②
が成立します。この2式を使って、水溶液中の![]() 、
、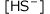 、
、![]() の各濃度を求めてみましょう。
の各濃度を求めてみましょう。
![]() を求めるには、一段目の電離だけを考えて、二段目の電離を無視します。というのも、2価の弱酸の場合、一段目より二段目の電離度が極めて小さいこと、一段目の電離によって生じた
を求めるには、一段目の電離だけを考えて、二段目の電離を無視します。というのも、2価の弱酸の場合、一段目より二段目の電離度が極めて小さいこと、一段目の電離によって生じた![]() があるため、ルシャトリエの原理より二段目の電離がおさえられること、が理由です。
があるため、ルシャトリエの原理より二段目の電離がおさえられること、が理由です。
※目安としては![]() と、
と、![]() が
が![]() 倍程度離れていた時に無視できますが、高校の問題では、通常、無視します。
倍程度離れていた時に無視できますが、高校の問題では、通常、無視します。
そうしないと4次方程式を解くことになってしまう、高校レベルを超えてしまうからです。
一段目の電離だけなら、1価の弱酸の電離と同じです。一段目の電離度を![]() 、
、![]() ≪1、電離前の
≪1、電離前の![]() の濃度をC(mol/L)とすると、この水溶液の濃度は下表のようになっています。
の濃度をC(mol/L)とすると、この水溶液の濃度は下表のようになっています。
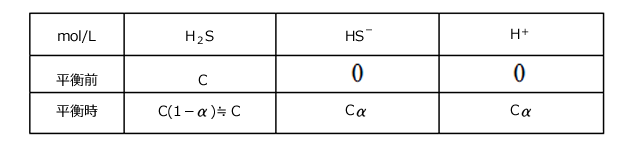
①の結果から、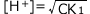 (mol/L)とすることができます。
(mol/L)とすることができます。
二段目の電離を無視する場合、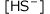 =
=![]() となりますね。従って
となりますね。従って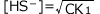 (mol/L)となります。
(mol/L)となります。
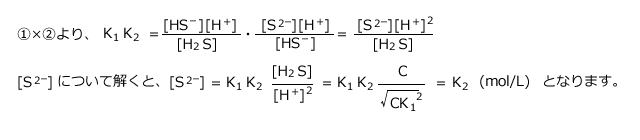
iv)3価の弱酸の電離:リン酸
3価の弱酸の例として硫化水素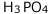 について考えます。
について考えます。
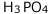 は次のような二段階の電離をします。
は次のような二段階の電離をします。

リン酸も![]() と同様に
と同様に![]() について二段目以降の電離を無視します。
について二段目以降の電離を無視します。
一段目の電離だけなら、1価の弱酸の電離と同じですね。
一段目の電離度を![]() 、
、![]() ≪1、電離前の
≪1、電離前の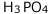 の濃度をC(mol/L)とすると、この水溶液の濃度は下表のようになっています。
の濃度をC(mol/L)とすると、この水溶液の濃度は下表のようになっています。
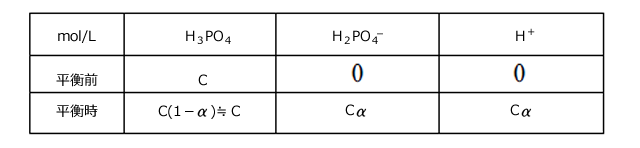

⑵ 電離平衡の正確な取扱い⇒質量作用の法則、物質量保存則、電気量保存則
⑴では二段目の電離を無視したりと多くの近似を用いましたが、ここでは、精密に数式を取り扱ってみようと思います。質量作用の法則はそれだけでは解くことができませんから、物質量保存則、電気量保存則(水溶液中の正電荷と負電荷の総和は0になる。)を用いて連立方程式を立てます。高校レベルでは実際に解くときは近似が必要ですが(笑)
物質量保存則
保存則というのは、反応や変化の前後で総量が変わらないという法則です。
例えば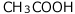 の一部が電離して
の一部が電離して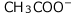 と
と![]() になる場合を考えてみます。
になる場合を考えてみます。
この場合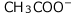 に着目すると、最初は全て
に着目すると、最初は全て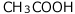 の形で存在しているのですが、電離平衡に達した時には
の形で存在しているのですが、電離平衡に達した時には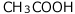 と
と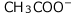 の形になっています。しかし、その総和は変化しません。
の形になっています。しかし、その総和は変化しません。
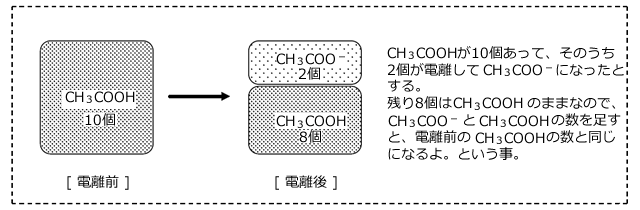
従って、C(mol/L)の酢酸水溶液においては、次の式が成立します。
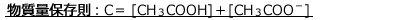
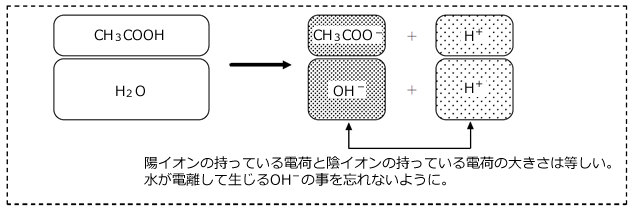
電気量保存則
水と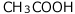 を溶かした場合、水も
を溶かした場合、水も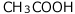 もも電気的に中性(正の電気量と負の電気量が等しい)なので、 電離平衡に達した時も、正の電気量と負の電気量は等しくなっているはずですね。
もも電気的に中性(正の電気量と負の電気量が等しい)なので、 電離平衡に達した時も、正の電気量と負の電気量は等しくなっているはずですね。
つまり、電気平衡に達した時の「陽イオンが持っている正の電気量の総和の大きさ」=「陰イオンが持っている負の電気量の総和の大きさ」が成立する。
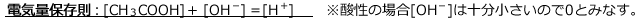
i)酢酸の電離
C(mol/L)の酢酸水溶液の![]() について考えます。
について考えます。
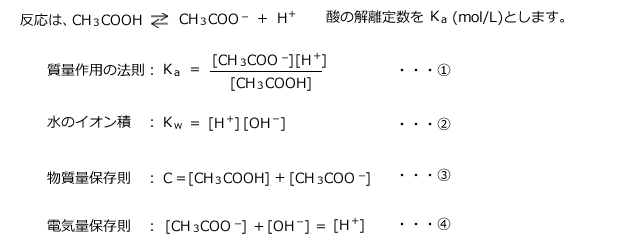
与えられた値は、![]() 、
、![]() 、Cのみで、[CH3COOH]、[CH3COO-]、[
、Cのみで、[CH3COOH]、[CH3COO-]、[![]() ]、[
]、[![]() ]は未知数です。
]は未知数です。
方程式は4本あるので解くことが出来ますが、3次方程式が出てきてしまい、手計算では解答不能です。
実際に[![]() ]を求めてみようとしてみます。
]を求めてみようとしてみます。

さて[![]() ]、を精密に求めるには、この3次方程式を解けばよい。
]、を精密に求めるには、この3次方程式を解けばよい。
でも、これを解くのは非常に困難ですね。
そこで、近似を用います。
酸性の場合、[![]() ]は[
]は[![]() ]に比べて十分小さい(pH=3ならば
]に比べて十分小さい(pH=3ならば![]() 倍違う)ので、これを無視します。
倍違う)ので、これを無視します。

ii)炭酸の電離
C(mol/L)の炭酸水溶液の[![]() ]について考えます。
]について考えます。
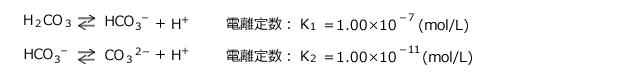
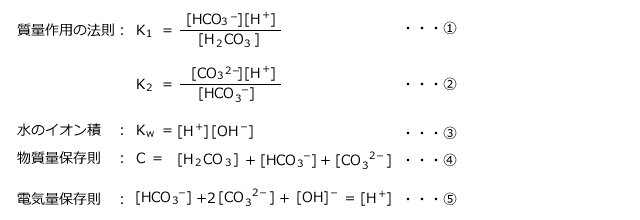
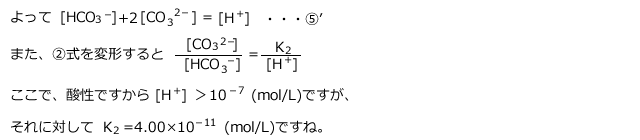
①~⑤を解くには近似が必要です。⑴ではこれは無視できる、という天下り的な与え方でした。
しかし、今回は式を変形しながら、近似して良い理由を説明します。
まず[![]() ]は酸性条件では[
]は酸性条件では[![]() ]に比べて十分小さな値でした。そこで、⑤から[
]に比べて十分小さな値でした。そこで、⑤から[![]() ]を無視することができます。
]を無視することができます。

⑶ 電気平衡の時の解離化学種の存在割合⇒質量作用の法則、物質量保存則、電気量保存則
大学の初年度で取り扱う内容ですが、医学部医学科の試験ではぽつぽつ出ています。そんなに難しい内容ではないのですが、知らないとできないですので、ここでマスターしておきましょう。
化学種の存在割合というのは、ある pH のとき、全濃度C(mol/L)に対して電離によって生じる各物質がどれくらいの割合で存在しているかを表す値です。
i)炭酸の電離
C(mol/L)n炭酸水溶液の![]() について考えます。
について考えます。
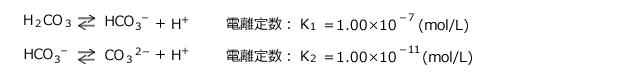
まず、必要な式を立てましょう⑵と同じように、質量作用の法則、水のイオン積、物質保存則、電気量保存則を立てます。
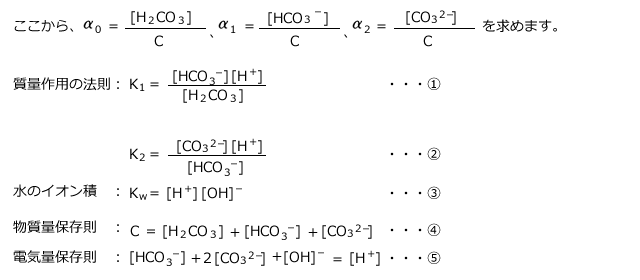
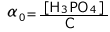 を求めます。④式の
を求めます。④式の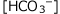 と
と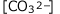 をそれぞれ
をそれぞれ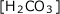 で表せばいいですね。
で表せばいいですね。


ii)リン酸の電離
C(mol/L)のリン酸水溶液の![]() について考えます。
について考えます。

リン酸についても炭酸と同様に考えればOKです。⑤の式を1つの化学種のみの式にしてしまえばいいのです。
全ての化学種の存在割合を求めるのは大変ですので、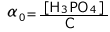 のみを求めてみようと思います。
のみを求めてみようと思います。