理論化学
化学講座 第55回:化学反応速度⑥ ルシャトリエの原理
変化に対する化学平衡の移動(ルシャトリエの原理)
今回はルシャトリエの原理について説明します。ルシャトリエの原理とは、平衡状態にある系に対して変化を与えた時、平衡が移動する方向を示すもので、平衡状態にある反応系において、状態変数(圧力(全圧)、温度、反応に関与する物質の分圧や濃度)を変化させると、その変化を相殺する方向へ平衡は移動する。という法則です。
簡単に言うと、系に何か変化を与えると、その変化を打ち消す方向に進むよ。という事なんですね。
加える変化の種類として圧力、温度、反応に関与する物質の分圧や濃度、の 3 つに分けて説明していきます。
説明には例として ① 吸熱反応 N2O4 ⇔ 2NO2 (-57.2 kJ) ② 発熱反応 N2 + 3H2 ⇔ 2NH3 +92 kJ の2種類を用います。
1)圧力(全圧)に変化を加えた場合
温度一定で、全圧を変化させると、その変化を打ち消す方向に平衡が移動します。圧力は分子数に比例しますので、全圧を大きくすると分子数が少なくなる方向に、全圧を小さくすると分子数が大きくなる方向に平衡が移動します。先ほど紹介した 2 種類の反応それぞれについて考えてみます。
- 【圧力を大きくする】⇒ 分子数が減少する(圧力を小さくする)方向に進む
- 【圧力を小さくする】⇒ 分子数が増加する(圧力を大きくする)方向に進む
① N2O4 ⇔ 2NO2 の場合
(1分子)⇔(2分子)
分子数は右辺の方が多く、左辺の方が少ないため、圧力を大きくすると平衡は左へ移動して分子数を減らし、圧力を小さくしようとします。一方、圧力を小さくすると平衡は右へ移動して分子数を増やし、圧力を大きくしようとします。
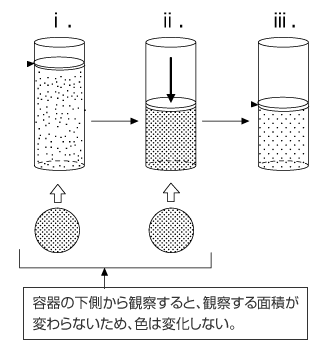
この実験では、N2O4 が無色、 NO2 が赤褐色であるため、色の変化が観察される。そのことから、色の変化について問われることもあります。
- 一定温度にして N2O4 をピストンに入れて静置すると、一部が NO2 となって平衡状態になる。
- ここに圧力を加えると、新しい平衡状態になる前に圧縮されて NO2 の濃度が高くなるので、横から見ると赤褐色が濃くなる。
- 体積を一定に保ってしばらく放置すると、NO2 が N2O4 になる反応が進むため色が薄くなる。ⅰ. より薄くなるかどうかは、計算しないとわからない。
② N2 + 3H2 ⇔ 2NH3 の場合
(4分子)⇔(2分子)
分子数は左辺の方が多く、右辺の方が少ないため、圧力を大きくすると平衡は右へ移動して分子数を減らし、圧力を小さくしようとします。一方、圧力を小さくすると平衡は左へ日どうして分子数を増やし、圧力を大きくしようとします。
2)温度に変化を加えた場合
圧力一定で、温度を変化させると、その変化を打ち消す方向に平衡が移動します。温度を高くすると、吸熱方向に、温度を低くすると発熱方向に平衡が移動します。これも先ほど紹介した 2 種類の反応それぞれについて考えてみます。
- 【温度を高くする】⇒ 熱量を吸収する(温度を下げる)方向に進む
- 【温度を低くする】⇒ 熱量が発生する(温度を上げる)方向に進む
① N2O4 ⇔ 2NO2 -57.2 kJ の場合
( 右向きは吸熱反応 )
右向きは吸熱反応、左向きは発熱反応なので、温度を高くすると右向きに、温度を低くすると左向きに平衡が移動します。
② N2 + 3H2 ⇔ 2NH3 +92 kJ の場合
( 右向きは発熱反応 )
右向きは発熱反応、左向きは吸熱反応なので、温度を高くすると左向きに、温度を低くすると右向きに平衡が移動します。
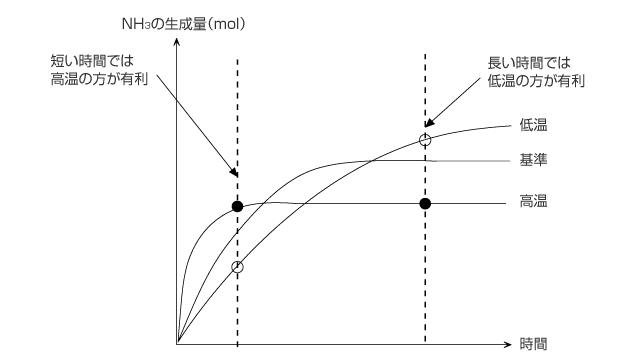
② の反応はハーバー ・ ボッシュ法と呼ばれ、NH3 の工業的製法です。1)、2)を合わせて考えると、この反応は高圧 ・ 低温で実施したほうが良いように思います。 しかし、実際は300~500 気圧、500℃ 程度という高圧、中程度の温度で反応を行います。ここで、温度を上げるのは反応速度を向上させるためです。 10℃ 上昇すると反応速度が 2 倍となる反応だった場合、200℃ と 500℃ では 230 ≒ 1.1×109 倍になりますから、平衡状態までまたず、高温で短い時間の反応を繰り返した方がより多くの NH3 を得ることができるのです。
3)反応に関与する濃度や分圧に変化を加えた場合
反応に関与する物質を加えて濃度や分圧を上昇させると、その物質を減少させる方向に反応が進みます。
これは ② の反応だけを例として説明します。
② N2 + 3H2 ⇔ 2NH3 +92 kJ
この反応が平衡に達しているところに、N2 を加えると、加えられた N2 を減少させる方向、すなわち右方向に反応が進行します。逆に、N2 を何らかの方法で取り除くと、取り除かれた N2 を増加させる方向、すなわち左方向に反応が進行します。
他にも、例えば、HCl を加えて右辺の NH3 を中和反応によって取り除くと、平衡は右方向に移動します。
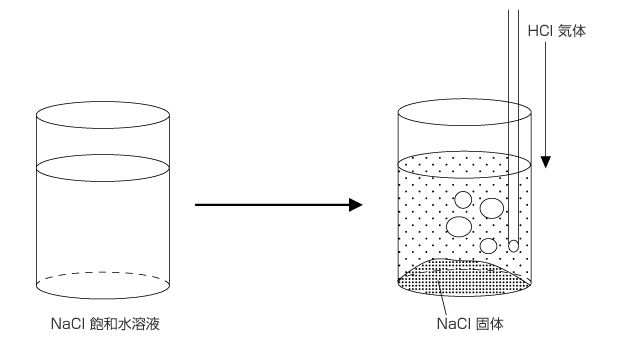
※ 共通イオン効果
溶質に含まれるイオンと同種のイオンを加えることにより、その溶質の溶解度が減少する現象を共通イオン効果といいます。
例えば、NaCl ⇔ Na+ + Cl- という溶解平衡を考えてみます。NaCl の飽和水溶液に HCl を通じると、水溶液中の Cl- 濃度が増加するため、溶解平衡が左に片寄って NaCl が析出します。 つまり、NaCl の溶解度が小さくなるのです。これを共通イオン効果と言います。
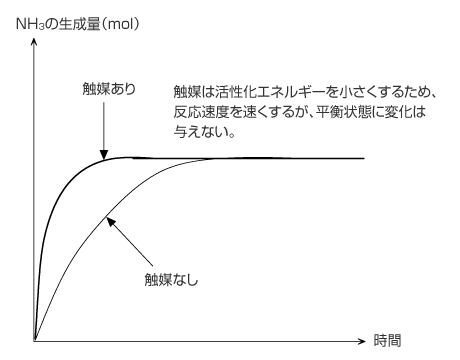
4)触媒を加えた場合
触媒を加えると反応速度が大きくなります。しかし、触媒を加えても平衡の位置は変化しません。
反応熱の大きさが変わらないのも前回お話しした通りです。
5)体積と温度一定で反応に関係ない気体を加えた場合
反応に関わらない気体を加えても、体積と温度が一定ならば反応物の圧力は変化しません。なぜなら、理想気体は気体分子間の相互作用が生じないためです。他の気体の圧力は何の影響も与えません。そのため、平衡は移動しません。
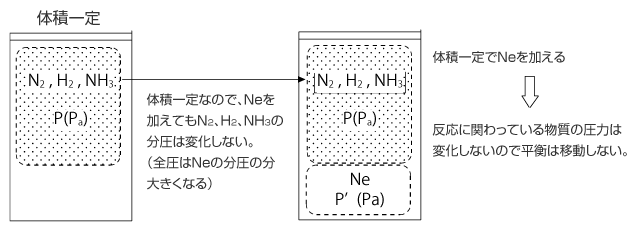
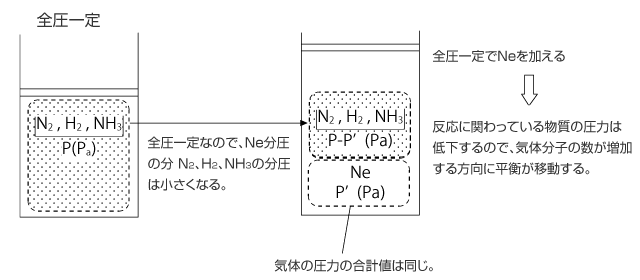
6)全圧と温度一定で反応に関係ない気体を加えた場合
全圧を一定に保って、反応に関係ない気体を加えると、その気体の分圧の大きさだけ反応にかかわる物質の圧力は低下します。従って、圧力を大きくする方向に平衡が移動します。
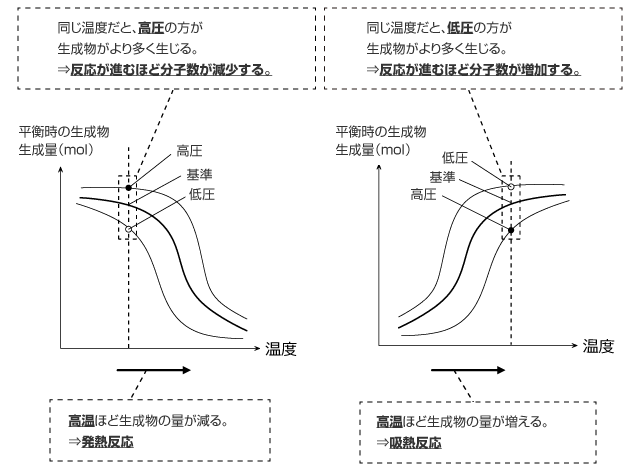
ルシャトリエの原理のグラフ
最後に、ルシャトリエの原理で良く出題されるグラフを説明します。
下図の二つがそのグラフなのですが、縦軸は平衡に達した時の生成物の生成量、横軸は温度になっています。
左側のグラフを見ると、右下がりになっています。ということは、温度が高いほど生成物は生じにくいことを示しています。
つまり、この反応が発熱反応であるという事を示しています。
逆に、右側のグラフでは温度が高いほど生成物が多く生じることを示しています。つまり、この反応が吸熱反応であることを示しています。
そして、両方とも 3 本ずつ線が引かれています。基準になる圧力、基準より低圧、基準より高圧の 3 本です。
左側のグラフを見てみると、同じ温度では高圧のものほど生成物が多く生じています。ということは、この反応は分子数が減少する反応であることが分かります。
逆に、右側のグラフでは低圧のものほど生成物が多く生じています。ということは、この反応は分子数が増加する反応であることが分かります。