理論化学
化学講座 第53回:化学反応速度④ 反応における熱の出入り
反応における熱の出入り(発熱反応と吸熱反応)
前回は反応のメカニズムと反応速度の式について説明しました。 今回は、反応に伴って出入りする熱量について説明します。
反応に伴う熱量を理解するには、下図のように横軸に反応の進行、縦軸に物質の持つポテンシャルエネルギーを取った図を利用します。前回使ったモデル A+B → C を使って説明します。
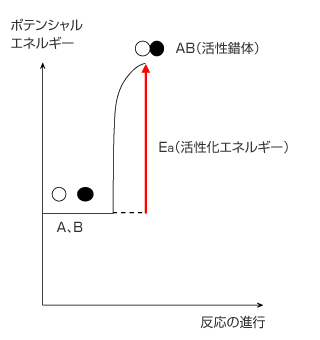
左図のように、反応物 A、B が活性錯体 AB になるには、持っているエネルギーの差分を吸収しなくてはいけません。このエネルギーの差分を活性化エネルギー Ea といい、このエネルギーは反応物 A、B の持っていた運動エネルギーからまかなわれます。A、B の持っている運動エネルギーが活性化エネルギーに満たない場合は活性錯体は生じず、A と B は反発して再びバラバラに動きます。
活性錯体 AB が生成物 C になるとき、発熱が起こりますが、この発熱 量 Q1 が Ea より大きいときはその差分の Q1 - Ea が外部に放出される発熱反応、逆に Ea より小さいときはその差分 Ea - Q1 が外部から吸収される吸熱反応となります。
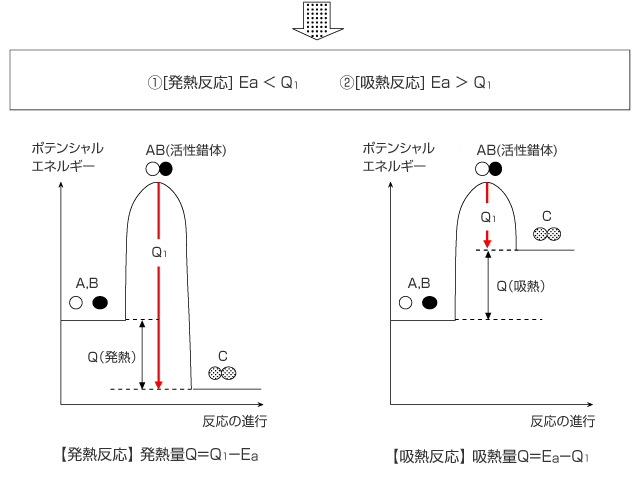
この図をよく見ると、反応により生じる熱や吸収される熱は、反応物のポテンシャルエネルギーと生成物のポテンシャルエネルギーの差ということがわかります。
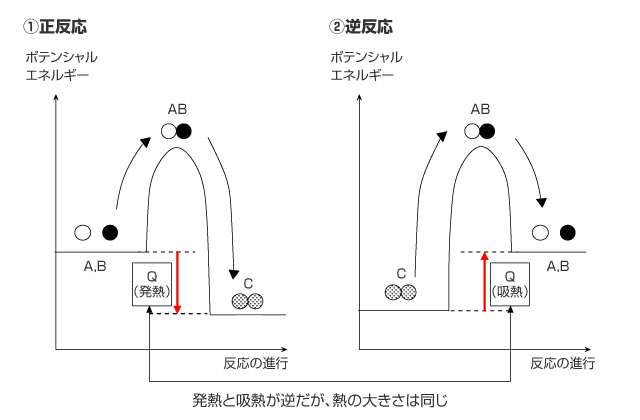
従って、生成物と反応物が逆になる反応、即ち、逆反応では正反応と発熱、吸熱が逆となり、その大きさは等しくなります。
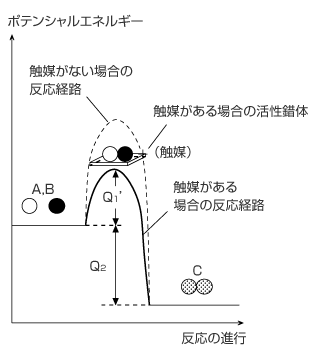
触媒が存在する場合の反応に伴う熱の出入り
次は、触媒を使った場合の反応に伴う熱の出入りについて考えてみます。
触媒というのは、そのものは反応の前後で変化しないが、反応速度を大きくする性質のある物質です。これは、触媒を用いると活性化エネルギーが減少するためです。どうして活性化エネルギーが小さくなるのかというと、触媒を用いると活性錯体がエネルギー的に安定になるためです。
触媒にはいくつか種類がありますが、H2 + I2 → 2HIの反応における吸着触媒(Niなど)の働きを例に説明します。

気体のH2と気体のI2を反応させる際、活性錯体は H2I2 という形になります。これは非常に不安定で、I2 と H2 という状態からこれを生成するには大きな活性化エネルギーが必要になります。
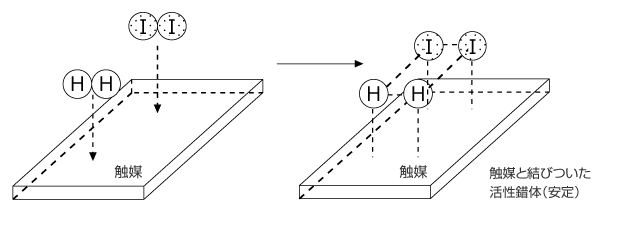
この反応で、触媒が存在する場合は、H2 と I2 がいったん触媒と結びつきます。すると、H2 、I2 の内部の共有結合がゆるくなって右上図のような状態になります。これが触媒と結びついた状態の活性錯体で、触媒と結びついている分だけ安定です。したがって、触媒がある場合は活性化エネルギーが小さくて済むのです。
触媒が存在する場合のエネルギーと反応の進行のグラフは右図のようになります。
活性化エネルギーが少なくて済む分、反応物が衝突した際に活性錯体になる割合が大きくなり、そのため、反応速度は速くなります。
しかし、反応の最初と最後のエネルギー状態 ( 反応物や生成物が持っているエネルギー ) が変化するわけではないので、反応熱の大きさは変化しません。