理論化学
化学連載 第47回:蒸気圧降下と沸点上昇
液体を加熱していくと、液体内部に小さな気泡が生じ始めます。この気泡は、液体が蒸発してできた蒸気の塊で、内部はその温度の飽和蒸気圧になっています。
さらに加熱を続けると、この小さな気泡は大きく成長するようになり、液体全体から気泡が発生するようになります。
この状態になると加熱しても温度上昇は起こりません。この現象を沸騰といい、沸騰が起こる温度を沸点といいます。
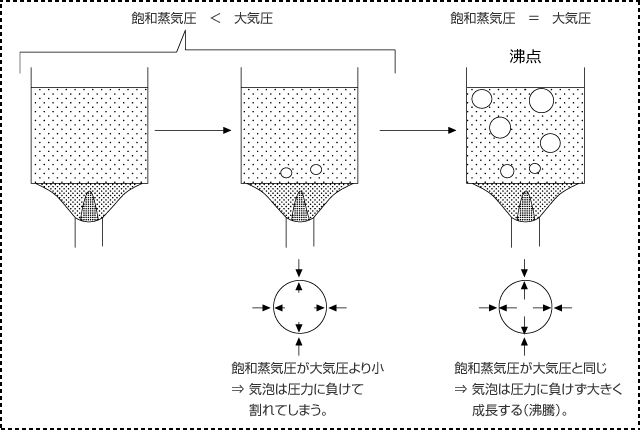
沸点になると気泡が大量に発生するようになるのはなぜでしょうか。実は、飽和蒸気圧の大きさに秘密があります。
飽和蒸気圧が大気圧より小さいときは、気泡の内部の圧力が大気圧より小さくなっているわけですから、気泡は生じた瞬間にまわりの水の圧力 ( 大気圧 ) に押しつぶされてしまいます。
しかし、飽和蒸気圧が大気圧に等しくなると、気泡は押しつぶされず、逆にまわりの液体が蒸発してくることから大きく成長するようになります。
このように、液体の表面からだけではなく、内部でも液体が蒸発して気泡が生じる現象を沸騰といいます。そして、沸騰が起こる温度の沸点は、飽和蒸気圧が大気圧に等しくなる温度なのです。
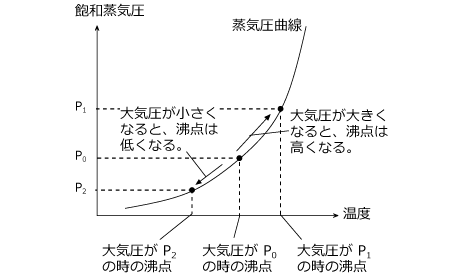
このように、沸点は大気圧の大きさによって変わります。大気圧が低いところ、たとえば山の頂上などでは、水の沸点は 70 ℃ 程度になります。
一方、大気圧が高いところ、例えば圧力釜の中などでは沸点は高くなり、 2 気圧の圧力釜の中に入れ場合、水の沸点は 120 ℃ 程度になります。
沸点は飽和蒸気圧と大気圧が等しくなる温度ですから、飽和蒸気圧が大きな気体ほど沸点が低くなります。これは飽和蒸気圧が高い=蒸発しやすいという事であることを考えればイメージできますね。
では、2 種類以上の成分が混ざった混合溶液の場合はどうなるのでしょうか。
沸点を考えるには蒸気圧を考える必要がありますから、まず混合溶液の蒸気圧について説明しましょう。
実は、混合溶液の蒸気圧は、( 各成分の飽和蒸気圧 ) × ( 各成分のモル分率 )の和で表すことができます。これをラウールの法則と言います。
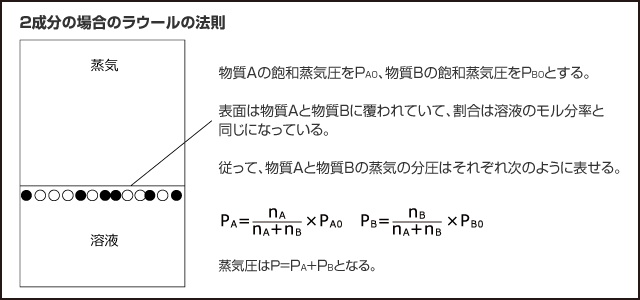
蒸気圧の全圧が、各成分の分圧の平均値になるという事ですから、感覚的にもわかりやすいんじゃないかな。と思います。
さて、二種類の物質を混合した場合のラウールの法則で、一方を揮発性の溶媒、もう一方を不揮発性の溶質として考えてみましょう。例えば、食塩水 ( 溶媒:水、不揮発性の溶質:食塩 ) や安息香酸のベンゼン溶液 ( 溶媒:ベンゼン、不揮発性の溶質:安息香酸 ) などです。
溶媒の分圧: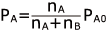 溶質の分圧:
溶質の分圧: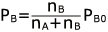
ここで、溶質の分圧は PB0 = 0 (不揮発性)ですから、 PB = 0 ですね。
よって、この溶液の蒸気圧は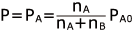 となります。
となります。
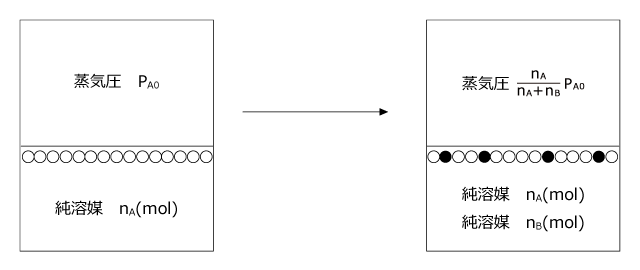
純溶媒の蒸気圧からどれだけ小さくなったかを考えてみましょう。その値を蒸気圧降下⊿P と表すと
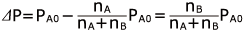
ここで、濃度が薄い場合 ( 高校化学では濃度の薄い溶液しか取り扱いません ) nA ( 溶媒 ) に対して nB は十分小さいので、 nA + nB ≒ nA とすることができますから、 と近似することができます。
と近似することができます。
ここで、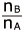 は溶液の質量モル濃度に比例しますね。つまり、 ⊿P が
は溶液の質量モル濃度に比例しますね。つまり、 ⊿P が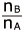 に比例するということは、 ⊿P は質量モル濃度に比例するのです。
に比例するということは、 ⊿P は質量モル濃度に比例するのです。
【 分からない人へ 】
M を溶媒の分子量とします。 nA M が溶質の質量(g)ですね。
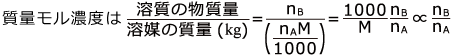
次に、この場合の沸点について考えてみましょう。
溶媒より蒸気圧が小さくなっているということは、溶媒の飽和蒸気圧が大気圧に等しくなる温度 ( 溶媒の沸点 ) になっても、溶液の飽和蒸気圧は大気圧に等しくなっていないという事ですね。
つまり、溶液の沸点は溶媒より高いことになります。この現象を沸点上昇といいます。
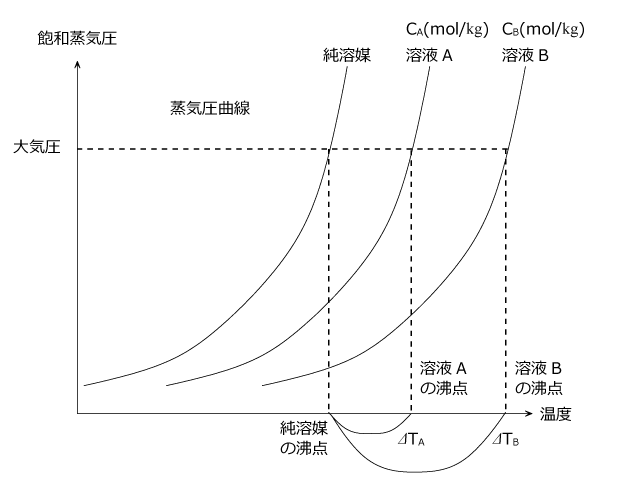
純溶媒より溶液の方が蒸気圧が低いので、溶液の蒸気圧曲線は純溶媒の右側にきて、下図のようになります。
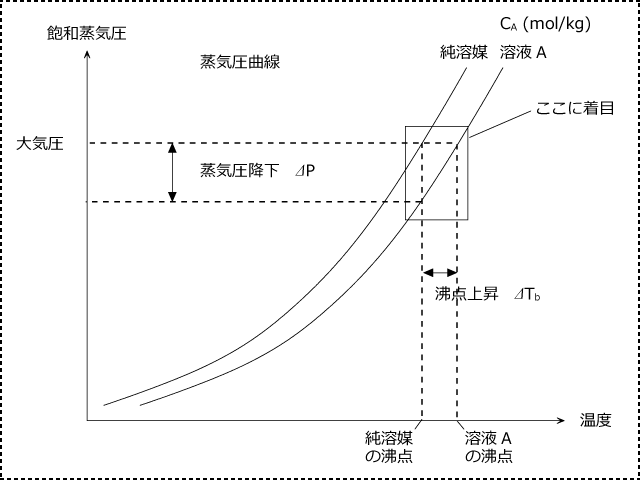
上図から蒸気圧降下と沸点上昇の関係を考えてみようと思います。四角部分に着目して、ここを拡大します。
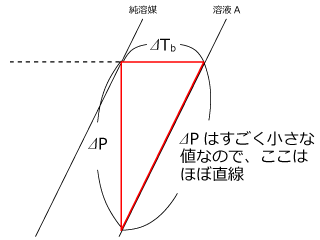
すると、 ⊿P は実はすごく小さな値なのでから、 ⊿Tb は ⊿P に比例し、 ⊿P は溶液の濃度 Cm に比例しますから、 ⊿Tb も Cm に比例します。
そこで、比例定数を Kb とすると。
⊿Tb = Kb Cm が成立します。
異なる濃度の溶液の蒸気圧曲線を取ると、下図のようになります。
ここで、沸点上昇度は溶液の質量モル濃度に比例して、 ⊿TA : ⊿TB = CA : CB となります。これも問題を解くうえでよく使う関係ですので、覚えておきましょう。