理論化学
化学講座 第45回:固体の溶解度(水和水あり)
CuSO4・5H2OはCuSO4とCuSO4を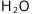 がなかだちして結びつけることでできている固体です。このように、結晶の中に
がなかだちして結びつけることでできている固体です。このように、結晶の中に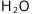 を含んでいる固体を水和物といい、含まれている
を含んでいる固体を水和物といい、含まれている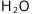 を結晶水と言います。
を結晶水と言います。
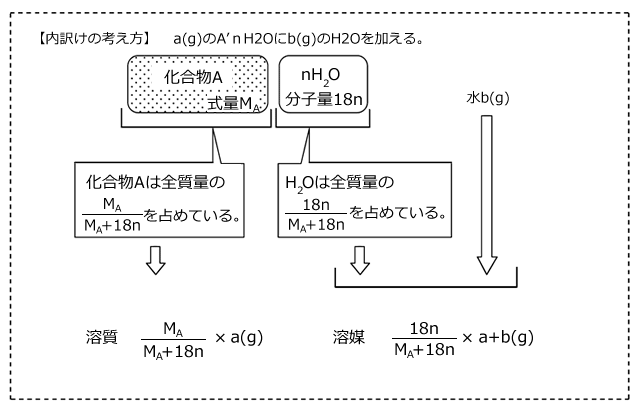
水和物を水に溶かす問題を考える場合、水和物の中に含まれている溶質と、![]() (溶解後は溶媒に加えられる)を分けて考えなくてはいけません。
(溶解後は溶媒に加えられる)を分けて考えなくてはいけません。
例えば、CuSO4・5H2O200(g)を水に溶かす場合を考えてみましょう。
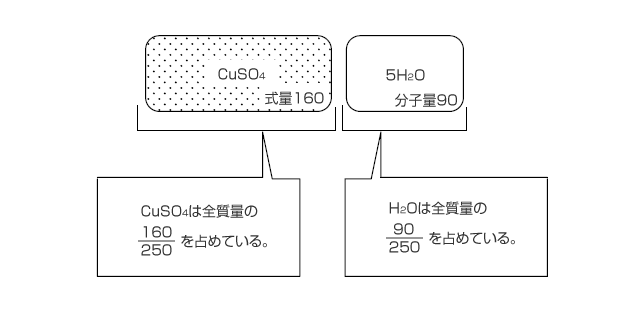
CuSO4・5H2Oの式量は250ですね。このうちCuSO4は160、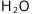 は18×5=90を占めています。
は18×5=90を占めています。
このことから、生じた水溶液を構成する溶質のCuSO4は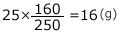 、溶媒の
、溶媒の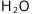 は、もともとあった200(g)に、CuSO4・5H2Oに含まれる
は、もともとあった200(g)に、CuSO4・5H2Oに含まれる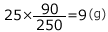 を合わせて、200+9=209(g)となります。
を合わせて、200+9=209(g)となります。
水和物としてよく出題されるものは、CuSO4・5H2O、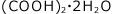 、
、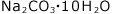 の3種類です。これらは、式量も覚えておきましょう。
の3種類です。これらは、式量も覚えておきましょう。

例題を解いてみましょう。
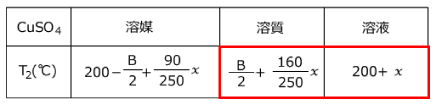
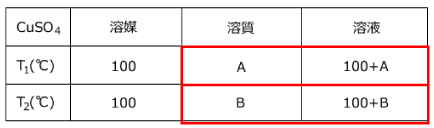
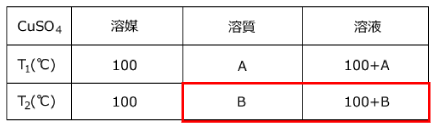
温度T1(℃)でのCuSO4の溶解度をA、温度T2(℃)でのCuSO4の溶解度をB (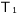 <
<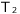 、A<Bとする。)
、A<Bとする。)
問題①:T1(℃)のCuSO4飽和水溶液200(g)を作るには、何(g)のCuSO4・5H2Oが必要か。
解答:まず溶解度の表を書きます。
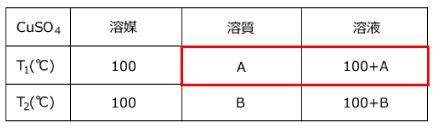
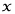 (g)のCuSO4・5H2Oが必要であるとする。ここに含まれるCuSO4は
(g)のCuSO4・5H2Oが必要であるとする。ここに含まれるCuSO4は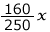 (g)、
(g)、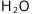 は
は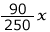 (g)である。また、作る飽和水溶液200(g)なので、水は200-
(g)である。また、作る飽和水溶液200(g)なので、水は200-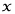 (g)加える必要があります。
(g)加える必要があります。

こうして表を書いてみると、溶質と溶液の所で比をとると良いことがわかりますね。
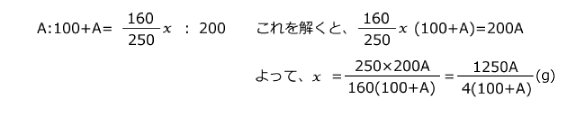
問題②:T2(℃)のCuSO4飽和水溶液200(g)をT1(℃)まで静かに冷却すると、何(g)のCuSO4・5H2Oが析出するか。
解答:まず溶解度の表を書きます。
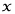 (g)のCuSO4・5H2Oが析出するとする。ここに含まれるCuSO4は
(g)のCuSO4・5H2Oが析出するとする。ここに含まれるCuSO4は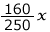 (g)、
(g)、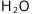 は
は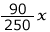 (g)です。
もともと、CuSO4が
(g)です。
もともと、CuSO4が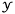 (g)溶解しているとします。
(g)溶解しているとします。


問題③:T2(℃)のCuSO4飽和水溶液200(g)を濃縮して30(g)の水を蒸発させた。何(g)のCuSO4・5H2Oが析出するか。
解答:まず溶解度の表を書きます。
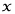 (g)のCuSO4・5H2Oが析出するとする。ここに含まれるCuSO4は
(g)のCuSO4・5H2Oが析出するとする。ここに含まれるCuSO4は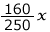 g、
g、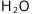 は
は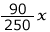 gですね。また、もともと、CuSO4が
gですね。また、もともと、CuSO4が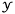 (g)溶解しているとします。
(g)溶解しているとします。

赤い四角に着目して、次の連立方程式を作り、これを解きます。
1)の赤い四角に着目して、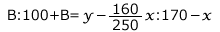 ・・・①
・・・①
2)の赤い四角に着目して、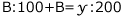 ・・・②
・・・②
②より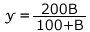 ・・・②'
・・・②'

問題④: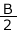 (g)のCuSO4をT2(℃)で水に溶かして200(g)にした。この溶液にあと何(g)のCuSO4・5H2Oを溶解することができるか。
(g)のCuSO4をT2(℃)で水に溶かして200(g)にした。この溶液にあと何(g)のCuSO4・5H2Oを溶解することができるか。
解答④:まず溶解度の表を書きます。

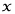 (g)のCuSO4・5H2Oが溶解できるとします。ここに含まれるCuSO4は
(g)のCuSO4・5H2Oが溶解できるとします。ここに含まれるCuSO4は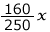 (g)、
(g)、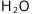 は
は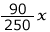 (g)です。
(g)です。