理論化学
化学講座 第31回:熱化学方程式①【状態変化と熱の出入り】
化学変化と状態変化
物質の変化には化学変化と、状態変化があります。
化学変化というのは化学反応式で表される変化で、物質を構成する原子の組み合わせの変化がおこり、反応物とは異なる物質が生じる変化です。例えば、HCl + NaOH → NaCl + H2O などがそうです。HClとNaOHという組み合わせがNaClとH2Oという組み合わせに変化しています。
一方、状態変化は物質そのものは変化しないが、物質を構成する分子イオンなどの集まり方が変化して、気体や、固体や、液体などの状態が変わる変化です。具体的な例をあげると、水が氷になったり、水蒸気が水になったりする変化です。
さて、今から状態変化について説明します。最初に、物質の状態を決定する要因について説明します。
分子や原子は温度に応じた熱運動をしています。温度が高いときは激しく、温度が低いときはゆるやかに運動しています。つまり、温度が高いほど、分子や原子は大きな運動エネルギーを持っているわけです。
温度が高いほど分子や原子は激しく熱運動をします。一方、分子や原子、イオンはお互いに引き付けあっています。この引き付けあう力は、温度による影響を受けません。
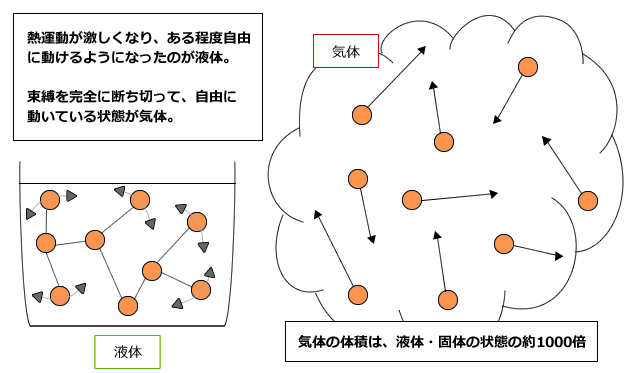
個体、液体、気体
温度が低いと熱運動によって自由に動こうとする力より束縛力の方が上回って、分子や原子やイオンは自由に動けなくなってしまいます。この状態が固体です。
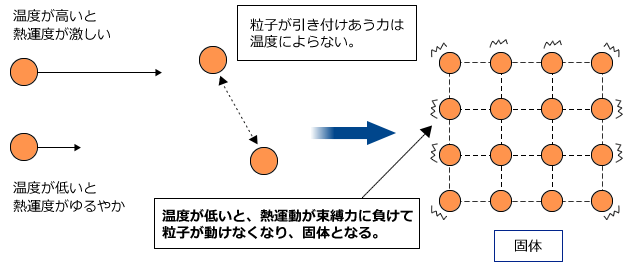
ここから少し温度を上げると、熱運動が少し激しくなり、束縛力に打ち勝つ部分が出てきます。すると、固体よりは粒子が自由に動けるようになって物質全体が流動性を持つようになります。この状態が液体です。
さらに温度を上げるとどうなるでしょうか。温度が上がり、ある程度熱運動が激しくなると、全ての束縛力に熱運動が勝って、すべての粒子が完全に自由に動き回れるようになります。この状態が気体です。気体は分子や原子が自由に動き回るため、固体や液体に比べて体積がずっと大きく、約1000倍程度の大きさになります。
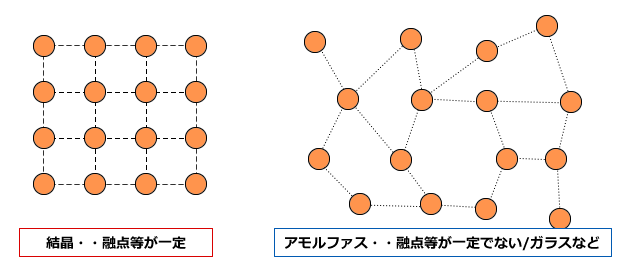
結晶と非結晶
固体は結晶と非結晶(アモルファス)の2種類に分けることができます。結晶というのは、分子や原子やイオンがきれいに配列した固体の事です。それに対して、アモルファスは固体になっているものの、分子や原子やイオンの配列が乱雑なもののことです。アモルファスの例には、ガラスがあります。ガラスは液体がそのまま固体になったというような表現をされるように、構成する原子の結びつき方が乱雑で、構造に結晶のような規則性がありません。
アモルファスは配列が乱雑ですから融点などの性質は一定していません。「これぐらいの温度で溶ける」という性質は決まっているのですが、必ずしもその温度で溶けるとは限らないのです。
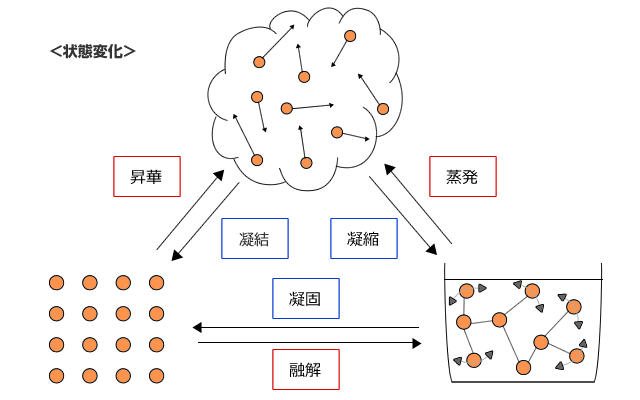
状態変化
固体が液体になる変化を融解、液体が気体になる変化を蒸発、気体が液体になる変化を凝縮、液体が固体になる変化を凝固といいます。また、固体が直接気体になったり、気体が直接固体になる反応をどちらも昇華、凝結といいます。
状態変化においては、熱量のやり取りが起こります。
例えば、液体が気体になる状態変化を考えてみましょう。
液体が気体になるときには、粒子をつないでいる結合を全て切断しなければいけません。粒子は引き付けあって結合しているのですから、これを切断するのにはエネルギーが必要です。つまり、熱エネルギーの吸収が起こります。
逆に、気体が液体になるときには、エネルギーがたくさんある状態から、エネルギーが少ない状態に変化するのですから、エネルギーの減少分は、熱として外部に放出されます。つまり、熱エネルギーの放出が起こるのです。
そのエネルギーは普通、熱エネルギーという形で与えます。たとえば、水を蒸発させようとすれば加熱しますが、これは外部から熱エネルギーを与えているのです。
このように、状態変化には熱エネルギーの吸収、放出が伴いますが、これらの熱には名前がついています。例えば、水1molを蒸発させるのに必要な熱エネルギーは蒸発熱ですし、氷1molを液体にするのに必要なエネルギーは融解熱といいます。
| 熱の名称 | 定義 |
|---|---|
| 融解熱 | 1molの固体が液体になるときに必要な熱量 |
| 蒸発熱 | 1molの液体が気体になるときに必要な熱量 |
| 凝固熱 | 1molの液体が固体になるときに放出される熱量 |
| 凝縮熱 | 1molの気体が液体になるときに放出される熱量 |
| 昇華熱 | 1molの個体が昇華するときに必要な熱量 |
| 凝結熱 | 1molの気体が凝結するときに放出される熱 |
このように状態変化には熱エネルギーの出入りが伴いますが、この熱エネルギーを測定するには、熱エネルギーによる温度の変化を用い、下式の関係から計算して求めます。
Q(加えた熱量) = C(比熱)×m(質量)×⊿T(温度変化)
比熱は、その物質1gを1℃温度上昇させるのに必要な熱量のことです。
ちょっと例題をやってみましょう。
- (例題)
-
50gの20℃の水があります。これを加熱したところ、温度が80℃になった。加えた熱量は何Jか。ただし、水の比熱は4.2J/(g・℃)とする。
- (解答・解説)
-
Jというのはエネルギーの量の単位です。熱もエネルギーの一種ですから、その量である熱量もJで表します。
解答は、先ほどの公式に数字を当てはめればいいですね。
Q = C×m×⊿Tより、Q = 4.2×50×(80-20) = 12600J = 12.6KJ
さて、今度は-20℃の氷を加熱して、120℃の水蒸気にする事を考えてみます。まず、どのような変化が観察されるでしょうか。
氷を熱すると、当然、溶けて水になります。水はあたため続けると水蒸気になります。ここまでは当たり前のように思えますが、温度変化は下図のようになります。
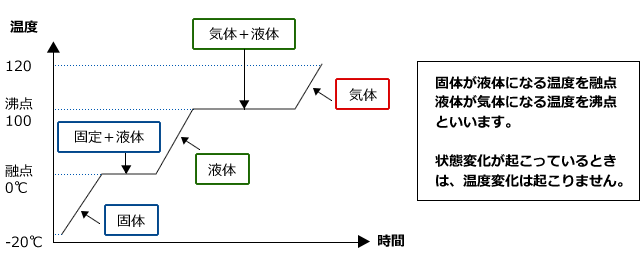
これは、中学校でもやりましたね、一旦温度が上がり、融解が始まって水と氷が共存するようになると、温度が一定になって、氷が全部解けると、また温度が上がりはじめます。では、なぜ融解や蒸発が始まると温度が変化しなくなるのでしょうか。
それは、加えた熱量が全て融解熱や蒸発熱として利用されてしまい、温度変化には用いられないからです。つまり、状態変化が起こっている間は熱エネルギーを加えても温度変化は起こらないのです。
今回はここまでとします。