理論化学
化学講座 第27回:電気分解【電気分解のルールと銅の電解製錬】
陰極での反応・・
陰極へは電源の負極から電子が流れ込み、極板は負に帯電しているので、溶液中の陽イオンが引き寄せられ、電子を受け取る還元反応が起こる。
| 反応のルール | ① 金属の陽イオンが溶けている場合はイオン化傾向がもっとも小さな金属が還元されて極板上に単体として析出する。 |
|---|---|
| ② 金属の陽イオンのうちK+、Ca2+、Na+、Mg2+、Al3+は還元されない。 | |
| ③ ②の場合、水溶液中の H+ または H2O が還元されて H2 が発生する。 (中・塩基性の場合: 2H2O + 2e- → H2↑ + 2OH-) ( 酸性の場合: 2H+ + 2e- → H2↑) |
陰極でK+、Ca2+、Na+、Mg2+、Al3+に電子を与え、単体を析出させることもできます。それには、これらの陽イオンを含む塩、例えば KCl、CaCl2、Al2O3 などを強熱して液体とし、電気分解をすればよく、これを融解塩電解と言います。
陽極での反応・・
陽極では、電源の正極へ向かって電子が吸い取られ、極板は正に帯電しているので、溶液中の陰イオンが引き寄せられ、電子を奪われる酸化反応が起こる。
| 反応のルール | ① 極板がAu、Pt、C以外の場合、極板が溶解する。 |
|---|---|
| ② ハロゲン化物イオンが存在する場合、優先的に反応する。 | |
| ③ SO42-、NO3-、PO43-は反応しない。 | |
| ④ 反応する陰イオンが存在しない場合、水が酸化されてO2が発生する。 ( 塩基性の場合 : 4OH- → O2↑ + 2H2O + 4e-) ( 中・酸性の場合: 2H2O → O2↑ + 4H+ + 4e-) |
さて、このルールを使って、今回・次回の二回にわたってさまざまな電気分解反応を説明します。
① 銅の電解製錬
CuSO4(aq)の電気分解で電極板にCuを用いた場合、陽極と陰極ではどんな反応が起こるでしょうか。

銅でできた陽極板が溶けて、陰極板に銅が析出しますから、陽極板から陰極板にCu が移動しているだけですね。
ここで、陽極に粗銅と呼ばれる、銅鉱石から取り出した不純物を含む銅を用いると、この反応を応用して銅を精錬する事ができます。(陰極に純銅が析出する。)
このように、電気分解によって銅を精錬する方法を銅の電解精錬と言います。
もう少し詳しく説明しましょうか。
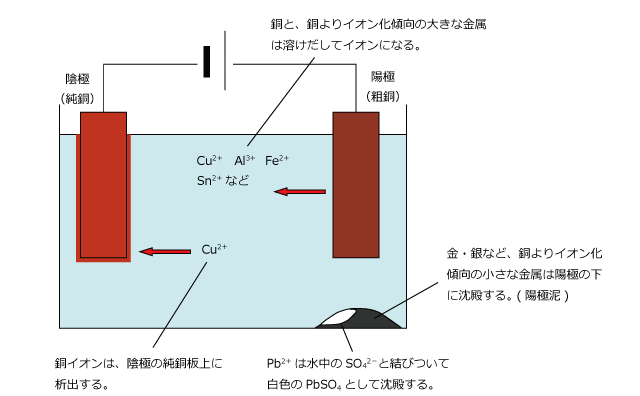
黄銅鉱を還元して得られる銅には、不純物としてアルミニウム、鉄、スズ、鉛、金、銀などの金属が含まれています。このような銅を粗銅といって、このままでは材料としての価値はあまりありません。
そこで粗銅を陽極に、純銅を陰極に、電解液を硫酸銅として電気分解を行うと、銅よりもイオン化傾向の大きな金属は銅と一緒に溶けだし、銅よりもイオン化傾向の小さな金属はイオン化せずに陽極の下に沈殿します。そして、溶液中に溶けだしたイオンの中でもっともイオン化傾向が小さい金属は銅なので、陰極の純銅板上には Cu が析出します。
こうして、不純物は陽極泥と溶液中に分離され、陰極では銅のみが回収されるのです。
陽極泥は金や銀、プラチナなどの貴金属を含むので、回収されて貴重な資金源となっています。また、陽極泥には白い沈殿が混ざりますが、これは PbSO4 です。Pb は銅よりイオン化傾向が大きいので、Pb2+ として溶け出しますが、すぐに溶液中の SO42- と結びついて沈殿するのです。
今回はここまで。次回はさらにさまざまな電気分解について説明します。