理論化学
化学講座 第26回:電池②(鉛蓄電池と燃料電池)
今回は実用電池を2つ説明します。1つは鉛蓄電池、もう1つは燃料電池です。
鉛蓄電池
鉛蓄電池は負極に Pb、正極に PbO2、電解液に希硫酸を用いた電池で、起電力が 2.1V あり、自動車のバッテリーなどに用いられている実用電池です。
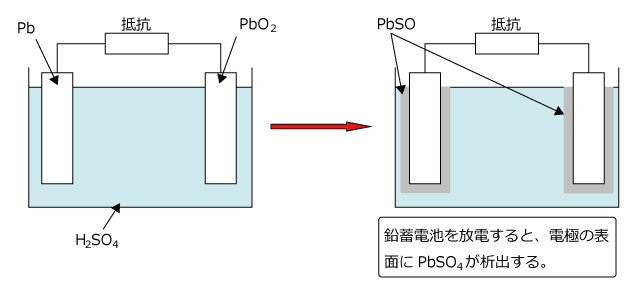
この電池は、放電すると正極にも負極にも水に不溶の PbSO4 が析出します。
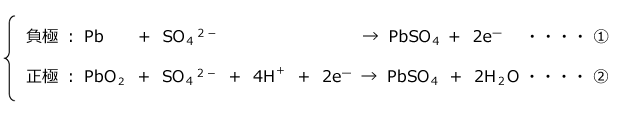
①と②の反応をまとめると鉛蓄電池の全反応式が完成します。
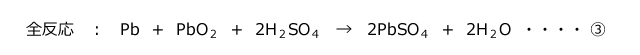
鉛蓄電池の特徴は、充電ができる電池だという事です。放電すると正極板にも負極板にも PbSO4 が析出しますが、そのため電流を放電時と逆向きに流すと上に並べた反応式と逆向きの反応が起こり、負極では PbSO4 が Pb に、正極では PbSO4 が PbO2 になる反応が起こり、電池は放電前の状態に戻ります。
このように充電可能な電池のことを、蓄電池あるいは二次電池といいます。
鉛蓄電池を題材とする問題では極板の質量変化や電解液の濃度変化が良く出題されますが、このような問題は、次の1~3を使って解くことができます。
1)負極の質量変化について
①式より、2mol の e- が通過すると、負極は Pb が PbSO4 に変化しますから、負極は SO4 1mol 分(96g) 質量が増加します。
→ 負極では 1mol の e- が通過するごとに 48g の質量増加が起こる。
2)正極の質量変化について
②式より、2mol の e- が通過すると、正極は PbO2 が PbSO4 に変化しますから、正極は SO2 1mol分(64g) 質量が増加します。
→ 正極では 1mol の e- が通過する毎に 32g の質量増加が起こる。
3)電解液の質量変化について
③式より、2mol の e- が通過すると、2mo lの H2SO4 が消費されて 2mol の H2O が生成しますから、電解液の質量は 98 × 2 - 18 × 2 = 160g 減少します。
→ 電解液は、1mol の e- が通過するごとに H2SO4 が98g減少し、H2O が 18g 増加する。 電解液全体は 80g 減少する。
ここまで、納得できましたか?では、次にこれらの知識を使って問題を一問解いてみましょう。
例題
鉛蓄電池の放電時の変化について、次の問いに答えよ。ただし有効数字 2桁で答えよ。
また、アボガドロ定数を 6.0 × 1023/mol とし、原子量は H=1、O=16、S=32、Pb=207 とする。
(1) 正極の質量が 12.8g 増加したとき、負極の質量は何g増加するか。
(2) このとき、電解液中の H2SO4 は何g 減少するか。
(解答)
(1)鉛蓄電池の負極では電子 1mol あたり 48g の、正極では電子 1mol あたり 32g の質量増加が起こる。したがって、正極の質量が 12.8g 増加した時、負極の質量が χ g 増加したとすると、次のような比の式が成立する。
12.8 : χ = 32 : 48
これを解いて、
χ
= 12.8 ×
![]() = 19.2 ≒ 19g
= 19.2 ≒ 19g
(2)鉛蓄電池の電解液は 1mol の電子が通過するごとに H2SO4 が 98g 減少する。H2SO4 の減少量をy gとすると、次のような比の式が成立する。
12.8 : y = 32 : 98
よって、y=12.8 ×
![]() = 39.2 ≒ 39g
= 39.2 ≒ 39g
燃料電池
燃料電池は、2H2 + O2 → 2H2O の反応(水素の燃焼反応)により生じる反応熱を電気エネルギーとして取り出す装置で、KOH 型と H3PO4 型の2種類があります。
まず、KOH 型燃料電池について説明します。この電池は反応により水が生じる事から、初めて月に到達した有人ロケット・アポロ11号にも搭載されていました。反応によって生じた水は飲料水にも用いられたのです。
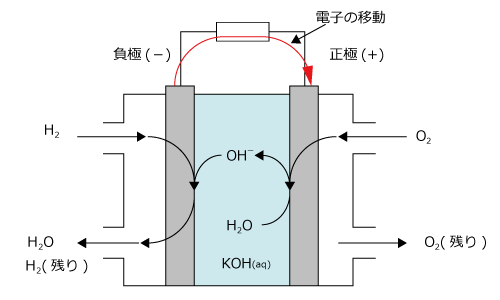
正極、負極とも多孔質の極板を用い、ここにH2、O2を吹き付けます。すると、正極、負極では以下の反応が起こり、回路に電流が流れます。
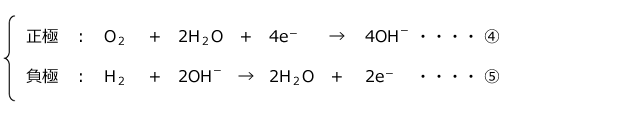
④と⑤の反応をまとめると
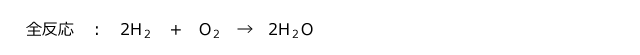
となり、H2の燃焼反応と同じになりますね。実は、燃料電池は水素の燃焼反応で生じるエネルギーを電気エネルギーとして取り出す装置なのです。
KOH 型燃料電池では負極側に水が生じるというのがポイントです。
次に、もう一つの燃料電池、H3PO4 型燃料電池を説明します。こちらは電解液が H+ を含んでいますので、正極側に H2O が生じます。KOH 型とは逆の極板に水が生じますので、注意してください。
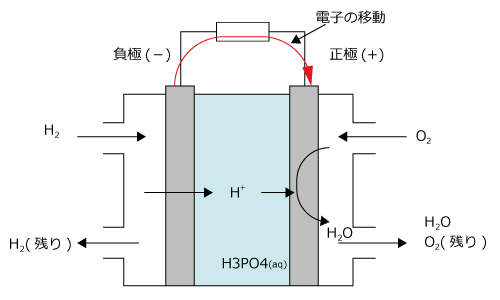
KOH型と同様に正極、負極ともに多孔質の極板を用い、ここにH2、O2を吹き付けます。すると、次の反応が起こって電流が流れます。
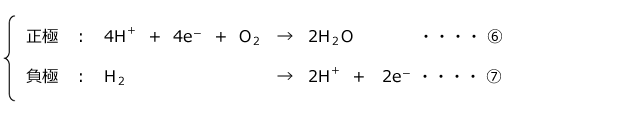
⑥と⑦の反応をまとめると
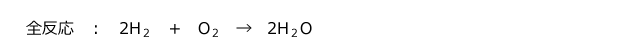
となりますから、やはりこれも H2 の燃焼反応になっていますね。
今回は鉛蓄電池と燃料電池という2種類の実用電池について説明しました。鉛蓄電池は計算が頻出ですからしっかり勉強しておいてくださいね。
次回からは電気分解について説明していきます。
それでは、今回はここまで。さようなら。





















































