理論化学
化学講座 第15回:酸と塩基(2)
今回は酸性・塩基性の度合い(液性)を表すのに用いる pH について説明します。
酸性は H+ の性質、塩基性は OH- の性質の事でしたね。ですから、酸性の強さを表すには H+ の濃度、塩基性の強さを表すには OH- の濃度を考えればよさそうです。
でも、溶液の性質を表すのに、酸性のときは H+ 、塩基性になると OH- の濃度を考えるのではちょっと不便ですね。できればどちらかに統一したいものです。
水中の H+ の濃度 [H+] と OH- の濃度 [OH-] の間には、 [H+]×[OH-]=10-14(mol/ℓ)2 という関係があります。この値のことを水のイオン積といって、25℃の水溶液では、その水溶液の種類によらず必ず成り立つ関係式です。
この式を変形すると、 [H+]=![]() (mol/ℓ) となりますから、 [OH-] から [H+] を求める事ができます。
これを使えば、 [OH-] から [H+] を計算できますから、 [OH-] を用いなくても [H+] の濃度だけで液性を表す事ができます。
(mol/ℓ) となりますから、 [OH-] から [H+] を求める事ができます。
これを使えば、 [OH-] から [H+] を計算できますから、 [OH-] を用いなくても [H+] の濃度だけで液性を表す事ができます。
それでは、25℃の水溶液が酸性・塩基性のときに [H+] がどのような値になるのか計算してみましょう。
まず中性のときの [H+] や [OH-] がどんな値になるのか、考えてみましょう。 [H+] > [OH-] のときが酸性、 [H+] < [OH-] のときが塩基性ですね。中性は [H+] = [OH-] の時ですから、 [H+] [OH-] = [H+]2 = 10-14(mol/ℓ)2 より [H+] = 10-7(mol/ℓ) の時です。
ということは、 10-7(mol/ℓ) より [H+] が大きいときは [H+] > [OH-] となり酸性、小さいときは [H+] < [OH-] となって塩基性です。
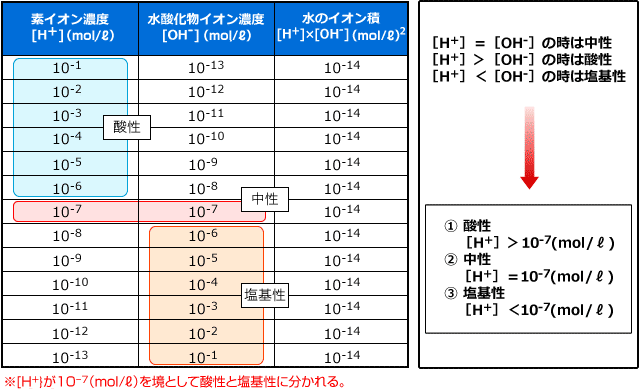
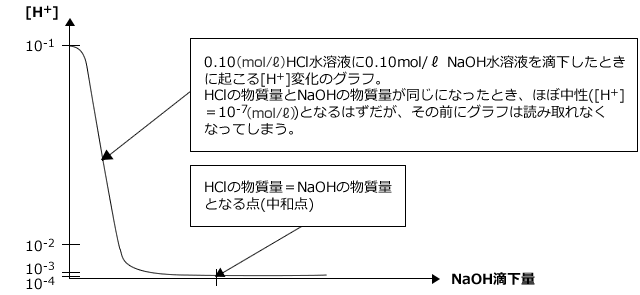
このように表にしてみるとわかりますが、 [H+] はとても大きな幅で変動します。例えば強酸性の 10-1(mol/ℓ) から強塩基性の 10-13(mol/ℓ) まで動くと、[H+] は1000000000000分の1の大きさになりますし、 10-1(mol/ℓ) から 10-3(mol/ℓ) に変化しただけでも100分の1になるわけですから、もし、これをグラフに描いたとすると、下のようにほとんど読み取る事ができないようなグラフになってしまいます。
そこで、 log10 を取って、[H+] の指数だけを調べる事にします。 log10[H+] では値が負になってしまいますから-をつけて、 -log10[H+] とします。この値を pH といいます。
pH = -log10[H+]
すると、 [H+] とpH の関係は下表のようになります。また、 NaOH 滴下量に対して [H+] ではなく pH を縦軸にとってグラフを描くと、 pH は [H+] の値がどんなに変化しても pH は 1~14 の間を動くので下図のようにちゃんと読み取ることができるグラフになります。
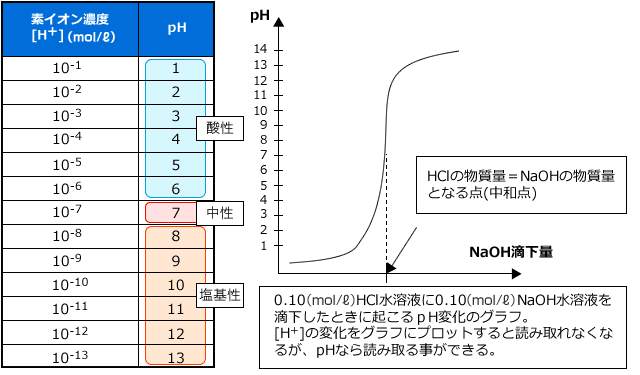
中性は [H+]= 10-7(mol/ℓ) の時でしたが、このときは pH=7 ですから、この値より大きいと塩基性、小さいと酸性と言うことになります。
pH <7 ・・・・ 酸性
pH =7 ・・・・ 中性
pH >7 ・・・・ 塩基性
◎数字が大きいほど塩基性が強く、数字が小さいほど酸性が強い。
では、ここで pH の計算の練習をしましょう。
例題
次の (1) ~ (5) の水溶液の pH を求めなさい。
-
0.010 (mol/ℓ) HCl 水溶液 (電離度1)
0.050 (mol/ℓ) H2SO4 水溶液 (電離度1)
0.040 (mol/ℓ) CH3COOH 水溶液 (電離度0.025)
-
0.010 (mol/ℓ) NaOH 水溶液 (電離度1)
-
1.0×10-5 (mol/ℓ) HCl 水溶液を1000倍に希釈した水溶液の [H+] を求めよ。
解説・解答
電離度とは溶質がどれくらいの割合で電離するかを表すものでした。例えば電離度 1 であれば、全ての溶質が電離します。一方、電離度 0.5 ならば溶質の半分が電離、 0.25 であれば溶質の 25% が電離します。
(1) 0.050 (mol/ℓ) HCl 水溶液 (電離度1)
溶液の pH を計算するには、まず [H+] の濃度を求めます。
電離度が1ですから、全ての HCl が電離します。
また、価数が1ですから、1つの HCl から放出される H+ の数は1つです。
よって、【HClの濃度】=【H+の濃度】になります。
[H+] = [HCl] = 0.010(mol/ℓ)
∴ pH = -log100.010 = 2.0
(H+の濃度) = (酸の濃度) × (電離度) × (価数) となります。
【解説】
(酸の濃度) × (電離度) を計算すると、電離した酸の濃度が分かります。
例えば、電離度 0.025 の 0.10(mol/ℓ) H3PO4であれば
電離している H3PO4 の濃度は 0.10(mol/ℓ) × 0.025 = 2.5 × 10-3 (mol/ℓ) ・・・ (1)となります。
酸が電離すると、1分子から価数に等しい数の H+ が放出されますから、
(酸の濃度) × (電離度) × (価数) が H+ の濃度となります。
(1) の例ならば、 [H+] = 0.10 × 0.025 × 3 = 7.5 × 10-3 (mol/ℓ)
塩基の場合は (OH-の濃度) = (塩基の濃度) × (電離度) × (価数) です。
(2) 0.050 (mol/ℓ) H2SO4 水溶液(電離度1)
[H+]= (酸の濃度) 0.050 × (電離度) 1 × (価数) 2 = 0.10 (mol/ℓ)
∴ pH = -log100.10 = 1.0
(3) 0.040 (mol/ℓ) CH3COOH 水溶液 (電離度0.025)
弱酸ですから、全て電離するわけではありません。
[H+] = (酸の濃度) 0.040 × (電離度) 0.025 × (価数) 1 = 0.0010(mol/ℓ)
∴ pH = -log100.001 = 3.0
(4) 0.010 (mol/ℓ) NaOH 水溶液(電離度1)
塩基の濃度から直接 [H+] を求める事はできません。まず、[OH-] を求めてから、水のイオン積を使って [H+] を求めます。
[OH-] = (塩基の濃度)0.010 × (電離度)1 × (価数)1 = 0.010(mol/ℓ)
水のイオン積より [H+] = ![]() =
= ![]() = 10-12(mol/ℓ)
= 10-12(mol/ℓ)
∴ pH = -log1010-12 = 12
(5) 1.0 × 10-5 (mol/ℓ) HCl 水溶液を1000倍に希釈した水溶液
1.0×10-5 (mol/ℓ) HCl 水溶液の [H+] は 10-5(mol/ℓ) です。
これを1000倍に希釈したので、[H+] = 10-8(mol/ℓ) としてしまいそうです。
しかし、1.0 × 10-5 (mol/ℓ) HCl 水溶液は酸ですから、これをどんなに希釈しても塩基性になるわけがありませんね。
実は、酸を希釈したときに、酸が放出する H+ の濃度が 10-7(mol/ℓ) に近い値、あるいはそれ以下になってしまう時は水の電離による H+ の濃度を無視することができなくなります。
水の電離による H+ の濃度を χ(mol/ℓ) とすると、水の電離は H2O → H+ + OH- ですから、水の電離によって生じる OH- の濃度も χ(mol/ℓ) です。
よって、この水溶液は [H+] = χ + 10-8(mol/ℓ)、 [OH-] = χ(mol/ℓ) となります。水のイオン積を使ってχを求めましょう。
[H+] [OH-] = 10-14(mol/ℓ)2 より (χ + 10-8 ) χ = 10-14(mol/ℓ)2
整理すると、 χ2 + 10-8 χ -10-14 = 0 となります。
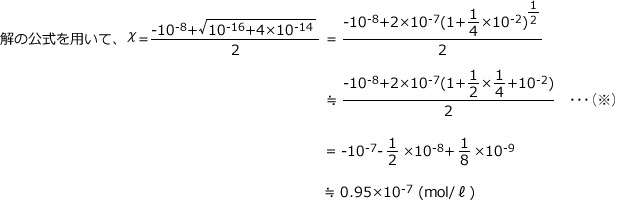
よって、 [H+] = χ + 10-8 = 1.05 × 10 -7 (mol/ℓ)
(※)の変形について。
h が 1 より十分に小さい値の時、 (1+h)n ≒ 1 + nh が成立します。
この近似は良く使うので、覚えておきましょう。
さて、以上で pH の説明はおしまいです。次は、中和点における pH と滴定曲線について説明します。滴定曲線というのは、酸に対して塩基を、あるいは塩基に対して酸を加えたときに起こるpH の変化を、縦軸に pH を、横軸に塩基あるいは酸の滴下量を取って表したグラフのことです。
塩基を酸に加えた場合の滴定曲線を下図に示します。滴定曲線には3つのパターンがあります。
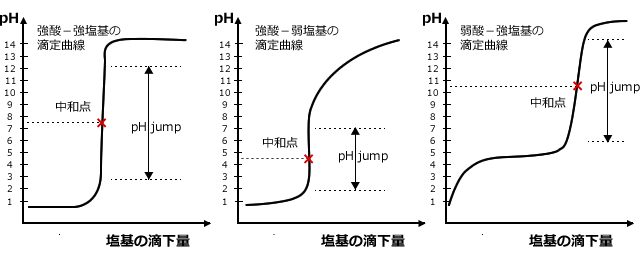
強酸-強塩基:中和点の pH はほぼ中性で、大きな pHjump
強酸-弱塩基:中和点の pH は酸性で、小さな pHjump
弱酸-強塩基:中和点の pH は塩基性で、小さな pHjump (中和点は、強いほうに偏る。)
それぞれ、 pH が大きく動く点がありますね。これを pHjump といい、この pHjump の真ん中の点を中和点と言います。中和点は酸の放出する H+ と塩基の放出する OH- の数が等しくなった点で、酸と塩基が完全に反応して水と塩の水溶液になる点です。
中和点・・【酸の放出する H+ の物質量】と【塩基の放出する OH- の物質量】が等しくなる点
3つのパターンを見てもらうと分かるように、 (1) の場合は中和点がほぼ中性ですが、 (2) と (3) ではそれぞれ中和点が酸性と塩基性にずれていますね。中和反応によって酸と塩基は反応してなくなってしまい、塩の水溶液になっているのに、なぜ、酸性や塩基性にずれるのでしょうか。実は塩は中性の物質ばかりではなく、酸性や塩基性のものがあるのです。
塩の水溶液が中性になるか酸性になるか塩基性になるかは、その塩がどのような酸・塩基の組み合わせで生じるかによって決まります。
強酸と強塩基の塩は中性 ・・ 例)NaCl、CaCl2、Na2SO4
弱酸と強塩基の塩は塩基性 ・・ 例)CH3COONa、Na2CO3、NaHCO3
強酸と弱塩基の塩は酸性 ・・ 例)NH4Cl、FeCl3
上の表のように、強いほうの性質が現れる、と考えてもらえばOKです。次回はこの塩の分類や性質についてもう少し詳しく説明します。また理論的な説明は、塩の加水分解で説明します。





















































