理論化学
化学講座 第11回:原子量、分子量、式量、気体の体積
化学の計算問題の基本は化学対応や状態変化がどのようにおこるかを知っていることと、そのときに消費、生成される物質の量を計算できることです。
そのためには、原子や分子の考え方を知らないといけません。そこで今回は原子や分子の数え方や質量の表し方について考えてみようと思います。
原子は、1つの大きさが10-10mくらいの小さな粒子です。ですから、これを1つ1つ数えていてはらちがあきません。
そこで、鉛筆をダース単位で数えるように、いくつかの原子をひとまとめにして数える事にします。このような考え方はずっと昔からあったのですが、何を基準に考えるかがなかなか決まりませんでした。やっと決まったのは1960年で、「12Cを12g集めたときの12C原子の数を1molとする。」と決められました。
測定の結果、これは約6.02×1023個であることが分かりました。この数字は、化学史上の偉人であるアボガドロにちなんで、アボガドロ定数と呼ばれています。また、molで数えた原子や分子の数を物質量と言います。容器に入っているCO2の物質量は1molなんていうように使います。
原子量
質量数12の炭素12の質量を12とする原子の相対質量を原子量といいます。
すると、原子量は質量数とほとんど同じ値となります。
たとえば、1Hは質量数1ですが、原子量は1.01、7Liは質量数7ですが、原子量は6.93というように、質量数と原子量は非常に近い値になります。
なぜ原子量と質量数が完全に一致しないのかというと、陽子と中性子の質量が、厳密には異なること、陽子と中性子が結合する際にほんの少しだけ質量が変化する現象(質量欠損)が起こることが原因です。
ところで、1Hや7Liの原子量は整数に近い値ですが、塩素や銅などは原子量がそれぞれ35.5、63.5と整数からかなり外れた値をとります。これは、質量数と原子量がほとんど同じになるのに対して、元素になるのに対して、元素になると質量数と原子量が食い違うのは、同位体が存在するためです。
このように、同位体か存在する元素では、同位体ごとにみると元素全体では原子量は整数である質量数とまったく異なる値をとります。
同位体を持つ元素の原子量は、同位体の原子量の平均値になるため、整数値から離れてしまうのです。
| 元素 | Cl | Cu | Mg | Zn |
|---|---|---|---|---|
| 原子量 | 35.5 | 65.5 | 24.3 | 65.4 |
| 同位体 | 35Cl 75.8% 37Cl 24.2% |
63Cu 69.2% 65Cu 30.8% |
24Mg 79.0% 25Mg 10.0% 26Mg 11.0% |
64Zn 48.6% 66Zn 27.9% 67Zn 4.1% 68Zn 18.8% 70Zn 0.6% |
例えば、塩素には35Clと37Clの2種類の同位体が存在します。35Clと37Clの原子量をそれぞれ35と37とし、存在比率は3:1であるとします。
このとき、Clの原子量は同位体の原子量の平均値ですから

分子量と式量
分子は、いくつかの原子の集まりです。ですから、分子1molの質量である分子量は、分子を構成する元素の原子量の和に等しくなりますね。
例えば、HClの分子量は1+35.5 = 36.5、CH3COOHの分子量は12×2+16×2+1×4 = 60 といった具合です。
一方で、イオン結晶や金属結晶、共有結合性結晶は分子を作りませんから分子量は定義できませんが、同じような考え方を組成式に適用して、それを式量と呼びます。
例えば、NaClの式量は23+35.5 = 58.5 です。
これは、Na+ 1molとCl- 1molからなる結晶の質量が58.5gであるという意味です。
また、混合気体の分子量は、構成する気体の分子量の平均値で考えます。(これを平均分子量と言います。)
例題
空気はおもにN2(窒素)とO2(酸素)で構成されていて、N2が80%、O2が20%を占めています。空気がこの2種類の分子から構成されていると仮定して、空気の平均分子量を求めなさい。
【解説・解答】
平均分子量は分子量の平均値です。N2の分子量は28、O2の分子量は32ですから、空気の分子量は以下の式で求める事ができます。
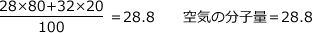
まとめ
- 1mol = 6.02×1023個
- 原子や分子は1個、2個で数えるには多すぎるので、molという単位で数える。 - 原子量
- 原子を1mol集めた時の質量、同位体がある場合は同位体の原子量の平均値 - 分子量・式量
- 化合物1molの質量、原子量の和で求める。
さて、原子量・分子量・式量は物質の物質量と物質の質量を変換するための量です。物質量と質量には次の関係があります。
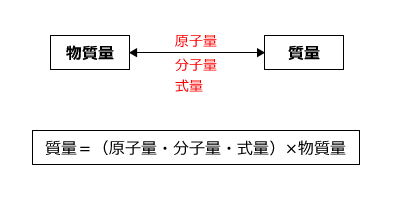
例題
- CO2 3.5molは何gか。
- NH3 3.4gは何molか。
【解説・解答】
- CO2の分子量は44なので、3.5×44=154g
- NH3の分子量は17なので
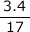 =0.2mol
=0.2mol
標準状態の気体の体積と物質量
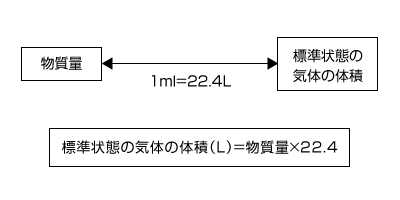
気体の体積は、物質量と温度と体積が等しければどの気体でも同じになります。0℃、1気圧(1.013×105Pa)の事を標準状態と言いますが、標準状態の1molの物質は、種類に関わらず必ず22.4ℓです。この数字は、必ず覚えておいて下さい。
これも2つほど例題を解いておきます。
例題
- CO2 3.5molは標準状態で何ℓか。
- 標準状態のNH3 5.6ℓは何molか。
【解説・解答】
- 標準状態で1molの気体の体積は22.4ℓなので、3.5×22.4=78.ℓ
- 標準状態で1molの気体の体積は22.4ℓなので、
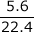 =0.25ℓ
=0.25ℓ
今回はちょっと短いですが、ここまで。