理論化学
化学講座 第9回:共有結合性結晶
非金属元素が共有結合で結びつくと、いくつかの原子が集まってできる分子が生じます。しかし、第14族の非金属元素だけは特別で、分子を作らずに、共有結合がどこまでも広がっていき、大きな原子の塊を作ります。この大きな原子の塊を共有結合性結晶といいます。
共有結合性結晶として出題される物質の種類は決まっています。それは下の5種類で、これら以外は覚えなくても大丈夫です。
出題頻度が多いのは炭素の単体であるダイヤモンドとグラファイトです。同じ炭素の単体でありながら構造と性質が全く異なるので、比較されながら出題されます。
- ダイヤモンド (炭素の単体:C)
- グラファイト (炭素の単体:C)
- ケイ素 (Si)
- 二酸化ケイ素 (SiO)
- カーボランダム (SiC)
ダイヤモンドとグラファイト(黒鉛)
炭素原子を使って単結合のみからなる共有結合性結晶を作ってみましょう。炭素は原子価が4で単結合を4本つくることができますから、1つの炭素に4つの炭素原子を結合させると、下図のような正四面体形の構造ができます。

次に、この正四面体構造の頂点にある炭素から新たに共有結合を3本ずつ作ります。その先に炭素が結びつき、その炭素からまた3つの共有結合を作って・・。これを繰り返していくと、いつまでたっても終わりません。その結果、正四面体構造が繰り返された、目に見える大きさの炭素のかたまりが生じます。これがダイヤモンドです。
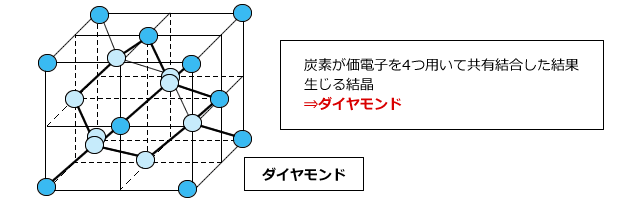
ダイヤモンドは共有結合のみでできているので非常に硬い結晶です。融点も高く、単体の中で一番融点の高い物質です。炭素の価電子は4つとも共有結合に使われて固定されていますから動く事ができません。したがって、ダイヤモンドは電気を通しません。ちなみに、熱は良く通します。
一方、ダイヤモンドの同素体のグラファイトは炭素が価電子を3つだけ使って単結合を繰り返した結果、六角形平面構造となり、それが層状に集まってできた物質です。4つある価電子が3つしか使われていませんから、価電子が1つあまってしまっています。この余っている価電子は層の中で自由に動き回れるので、グラファイトは電気を通します。このように物質中で自由に動く事ができる電子のことを自由電子といいます。
この六角形の平面構造の層の間に働いているのはファンデルワールス力です。ファンデルワールス力は非常に弱い力ですから、グラファイトは少し力を加えると層に平行な面で割れてしまいます。そのため、ダイヤモンドとは異なり軟らかい結晶で、鉛筆の芯などに用いられています。
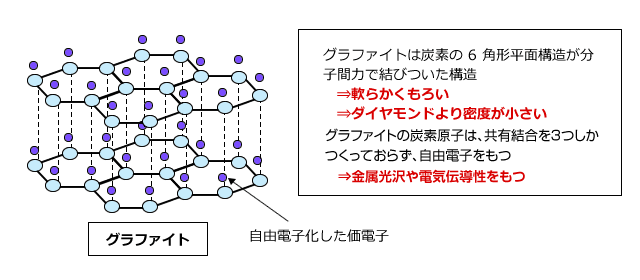
また、グラファイトは自由電子を持っているので金属光沢があります。非金属元素からなる物質で金属光沢を持つのはケイ素とグラファイトだけです。ケイ素は、見た目がほとんど金属です。やはり第14族の元素は変わった性質を持っていますね。
グラファイトとダイヤモンドはともに炭素の同素体です。炭素の同素体にはこのほかに無定形炭素(フラーレンやカーボンナノチューブを含む複数の構造が混ざったもの)がありますが、これらは分子であり共有結合性結晶ではありません。
| 名称 | ダイヤモンド | グラファイト(黒鉛) | 無定形炭素 |
|---|---|---|---|
| 構造 | 正四面体構造 | 正六角形状の平面層状構造 | フラーレンなどを含む |
| 特徴 | 無色透明 電気伝導性なし 非常に硬い |
黒色不透明 電気伝導性あり 薄くはがれやすく、軟らかい 金属光沢あり |
黒色不透明(一定の色は無い) 電気伝導性なし |
| 結合様式 | 共有結合のみ | 共有結合・分子間力 | 共有結合・分子間力 |
ちなみに、フラーレンは下図のような形状をしており、現在は医薬品としての応用が検討されているほか、美容液などに配合されています。
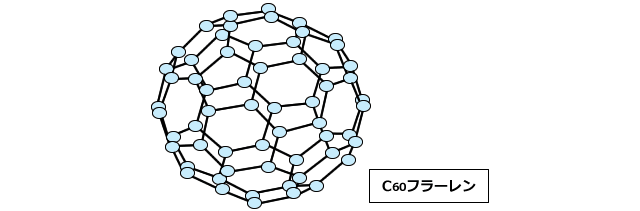
このフラーレンを用いた問題も時折出題されます。
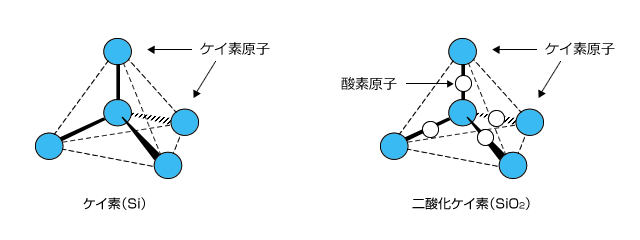
ケイ素と二酸化ケイ素
ケイ素と二酸化ケイ素はともに正四面体のダイヤモンド型結晶構造を持つ共有結合性結晶です。
ケイ素は金属光沢があり、わずかに電気を通す半導体としての性質をもちます。二酸化ケイ素はケイ素の正四面体構造のケイ素とケイ素の間に酸素がもぐりこんだような構造をもっています。二酸化ケイ素はケイ素と異なり、金属光沢も電気伝導性もありません。
二酸化ケイ素は地殻中に多量に含まれて(つまり石とか砂とか)おり、鉱物名を石英といいます。純粋なものは水晶と呼ばれ透明で硬い結晶です。また、二酸化ケイ素はガラスの主成分でもあります。
分子性物質と共有結合性結晶の性質
分子性物質と共有結合性結晶は共に共有結合でできている物質ですが、全く性質が異なります。それは、分子性物質は共有結合によって生じる原子のかたまりである分子が、弱い分子間力で結びついているのに対し、共有結合性結晶ではすべての結合が強い共有結合でできているためです。
| 名称 | 分子性物質 | 共有結合性結晶 |
|---|---|---|
| 構成粒子 | 分子 | 原子 |
| 化学式 | 分子式 | 組成式 |
| 結合の種類 | 共有結合・分子間力 | 共有結合 (グラファイトのみ分子間力も含む) |
| 固体の硬さ | 軟らかい | 極めて硬い (グラファイトは軟らかい) |
| 沸点・融点 | 低い 常温で気体・液体の物も多い 常温常圧で昇華する物質もある |
極めて高い |
| 電気伝導性 | 水中で電離して電気伝導性をしめすものがある。 | 電気を通さない (グラファイト・ケイ素を除く) |
このため、分子性物質が軟らかくもろい(ドライアイスなどを思い浮かべてください)のに対し、共有結合性結晶はグラファイトを除いてきわめて硬くダイヤモンドは単体中最高の硬度(モース硬度)を誇ります。
また、沸点・融点も共有結合が非常に高いのに対し、分子性結晶は低く、一部の分子性物質は常温常圧で昇華します。昇華する物質は覚えておいてください。ドライアイス・ヨウ素・ナフタレンの3種類です。
今回はちょっと短いですが、これでおしまいです。





















































