理論化学
第6回:金属と非金属、化学結合①(共有結合)
金属元素と非金属元素
元素は、非金属元素と金属元素に大別されます。
前回までの講義で周期表の意味が理解できたと思います。おさらいをしておくと、周期表の右上のものほど電子を引き付ける力が強くて陰イオンになりやすく、左下のものほど電子を引き付ける力が弱くて陽イオンになりやすくなります。しかし、希ガスは自らの最外殻電子を引きつける力は強いものの安定な閉殻またはオクテットの状態のため、陽イオンにも陰イオンにもなりにくいのでした。今日は、これを元にして、いろいろお話していこうと思います。
ちょうど、周期表で言うと下図のように分けられます。右上が非金属元素、左下が金属元素ですね。
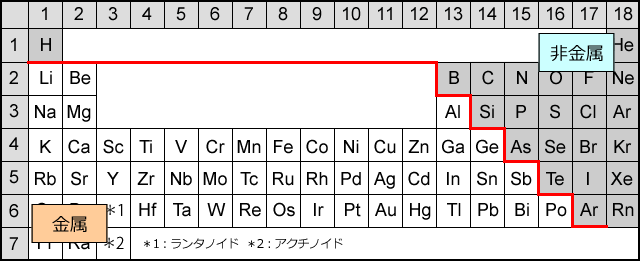
良く見てみると、非金属元素は右上の方にかたまっていて金属元素は左下の方にかたまっています。
ということは、希ガスを除いて、非金属元素は電子を引き付ける力が強くて陰イオンになりやすい元素、金属元素は電子を引き付ける力が弱くて陽イオンになりやすい元素だと言えます。
当然、イオン化エネルギーや電子親和力の大きさも、非金属元素は大きくて、金属元素は小さくなります。
- 金属元素 …イオン化エネルギーと電子親和力と電気陰性度が小さく、陽イオンになりやすい元素
- 非金属元素…イオン化エネルギーと電子親和力と電気陰性度が大きく、陰イオンになりやすい元素
※希ガスは、非金属です。
化学結合
原子は希ガスを除いて最外殻電子数が8個ではないので、そのままでは不安定です。そこで、原子間で電子をやり取りしますが、このとき、電子をやり取りした原子同士はお互いに引き付けあって結びつきます。この結びつきを化学結合といいます。
化学結合には次の3つがあります。これからしばらくの間、この化学結合とその結果生じる物質の性質に焦点を当てていこうと思います。
① 共有結合(配位結合) ② イオン結合 ③ 金属結合
① 共有結合
共有結合は、2つの原子が互いに電子を出しあってつくった電子対を共有する事により生じる結合で、電子を引き付ける力の大きな元素同士、つまり非金属元素同士が結合するときに生じます。
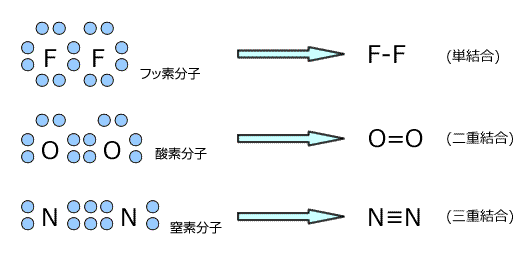
例として、F原子とF原子の間に生じる共有結合について考えてみます。Fは最外殻に7つの電子を持つ非金属元素ですから、あと1つ電子を受け取る事ができればオクテットになって安定になります。ですから、他の原子から電子を奪う力が非常に強い原子でしたね。
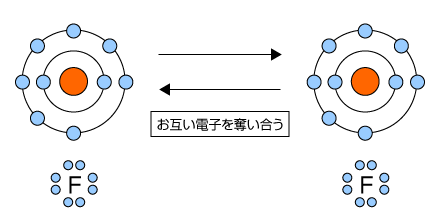
2つのF原子が接近すると、お互い電子を奪おうとして争奪戦が始まります。しかし、電気陰性度が同じですから勝負がつきません。
そこで、F原子は電子を一つずつ出し合って電子対をつくり、それを共有する事にします。
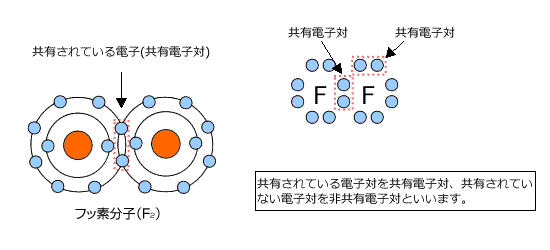
すると、2つのF原子の最外殻電子数はともに8個になり、オクテットの状態になって安定化します。
そうすると、この2つのF原子は離れることができなくなり、結合します。
このように、電子を共有することによって2つのF原子は結びつき、F2という形になります。
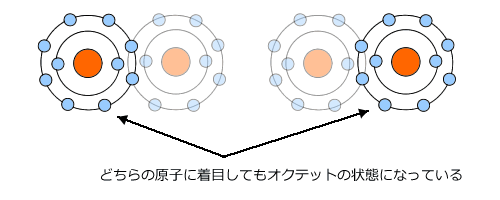
このように電子対を共有することによって作られる結合の事を共有結合といい、その結果生じる原子のかたまり(この場合は F2)を分子といいます。
共有結合は、非金属原子同士が、互いの最外殻電子数を8つにしようとして生じるものですから、元々持っている最外殻電子数によって共有電子対の数が変わります。
例えば、Oの場合だと、ともに最外殻電子数が6でオクテットまであと2つの状態です。そこで、互いに電子を2つずつ出し合って2つの共有電子対をつくって結合します。
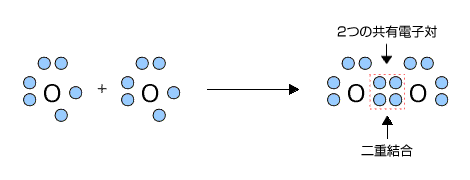
共有電子対が1つで生じる共有結合を単結合、共有電子対が2つで生じる結合を二重結合といいます。
共有電子対が3つなら三重結合という事ですが、三重結合の例にはN2などが挙げられます。
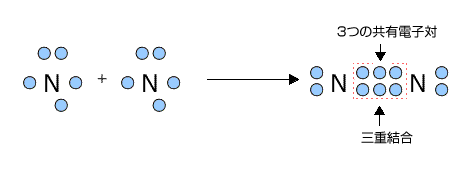
化学式では、この共有結合を-(価標といいます)で表します。
(-)1つは共有電子対1つを意味します。
ですから二重結合は=、三重結合は≡で表します。
共有結合は異なる種類の非金属原子間にも生じます。例えば、CH4(メタン)とCH3COOH(酢酸)の中に生じている共有結合を考えてみましょう。
これらの分子の中でも各原子がオクテットになるように電子が共有されます。
電子式を書いてみると下図のようになりますが、うまい具合に最外殻電子数が8(水素は2で閉殻)になっていますね。
①メタンの場合
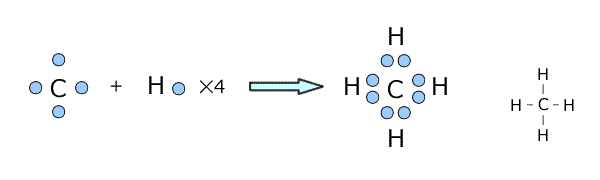
②酢酸の場合
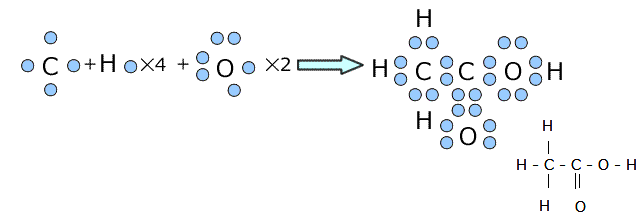
このように、分子の構造というのは、でたらめに原子が共有結合をしているのではなく、すべての原子の最外殻電子の配置が、オクテットあるいは閉殻、つまり、希ガス型になるようにできているのです。
分子の形状
次に分子の形状について説明します。
まずは基本的なものを覚えましょう。下の8個です。
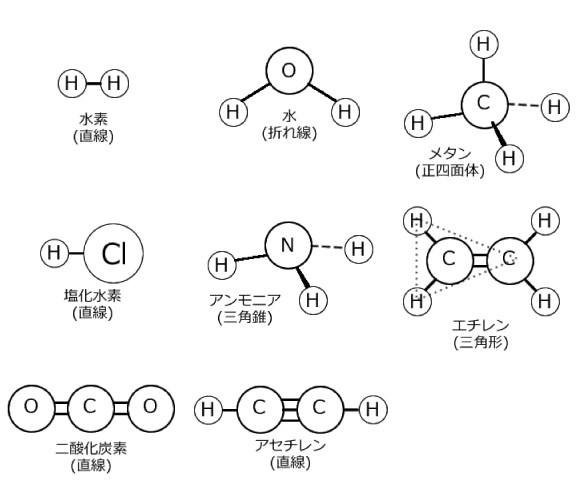
有名なものばかりですが、知らないものがあったらここで覚えておいてくださいね。あ、エチレンはどこが三角形なの?と思うかもしれないですけど、これは、1つのC原子を中心として隣のC、それから二つのHが三角形の頂点になっているという事です。
これら8個の形状は覚えておくべきですが、では、SO2の構造はどうでしょう。H2O2は?すべての分子の形状を覚えるわけにはいきませんから、形状を決めるルールを覚えておきましょう。
分子の形状を決めるのは、中心原子に直接結合している原子の数と、中心原子の持つ非共有電子対の数の和です。
| 中心原子に結合している原子の数 +非共有電子の数の和 |
中心原子の周りの電子対・原子の配置 |
|---|---|
| 2 | 直線 |
| 3 | 三角形 |
| 4 | 四面体 |
ふーん。折れ線とか、三角錐とか、ないじゃん。と思ったかもしれませんね。この表に書いたのは電子対も含めた構造です。普通、分子の構造では電子対は書きません。折れ線や三角錐は三角形型や正四面体構造の分子の電子対を省略したものなのです。
先ほどの8つの分子を使って説明します。
まず、中心原子に結合している原子の数+非共有電子対の数の和が2のものから。中心原子の周りの電子の配置を確認するために、まずは電子式を書いてみます。
中心原子に結合している原子の数+非共有電子対数=2のもの
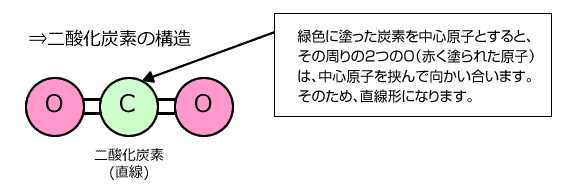
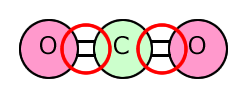
①二酸化炭素 CO2
| 電子式 | 構造についての説明 |
|---|---|
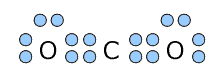 |
中心にあるC元素は2つのO原子とそれぞれ二重結合で結びついていて、非共有電子対を持ちません。したがって、Cの周りには二重結合が2本あるだけです。 よって、原子の数+非共有電子対の数の和=2ですから、直線構造ということになるんです。 |
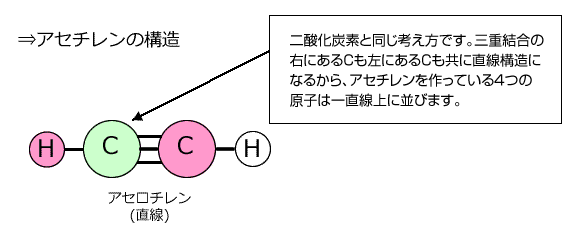
②アセチレン C2H2
| 電子式 | 構造についての説明 |
|---|---|
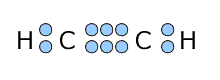 |
左側のCに着目してみると、単結合1つと三重結合1つの計2つの結合をしていて、非共有電子対は持っていません。 ということは、このCとこの周りにいるHともう1つのCは直線上にあることになります。さらに、もう1つの、三重結合の右側にあるCについても同じことが言えますから、アセチレン分子は全体で直線になります。 |
中心原子に結合している原子の数+非共有電子対数=3のもの
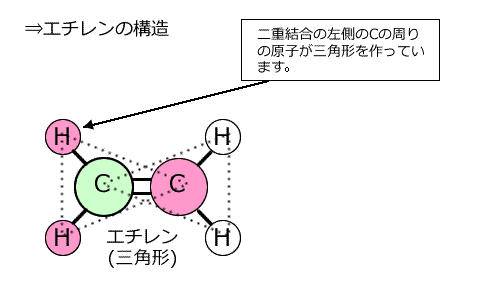
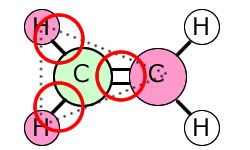
①エチレン C2H4
| 電子式 | 構造についての説明 |
|---|---|
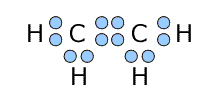 |
左側のCに着目してみると、単結合2つと二重結合1つの計3つの結合をしていて、非共有電子対は持っていませんね。 ということは、このCとこの周りにいるつのHともう1つのCは三角形を作っていることになります。 二重結合の右側にいるCも同じですから、この分子は三角形の構造が2つでできているわけです。 |
中心原子に結合している電子の数+非共有電子対数=4のもの
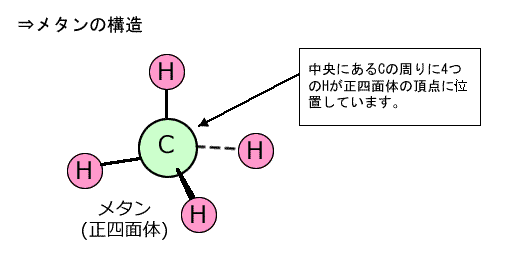
①メタン CH4
| 電子式 | 構造についての説明 |
|---|---|
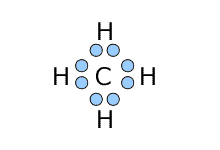 |
中心のCに着目すると、周りにある4つのHと単結合をしていますから、中心のCの周りにある4つのHは、Cを中心とした四面体構造になっています。しかも4つのHは等価なので、Cを中心とした対称性を持ちます。つまり、正四面体型になります。 |
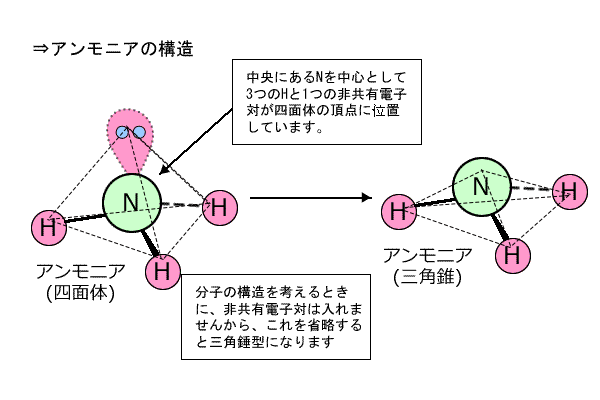
②アンモニア
| 電子式 | 構造についての説明 |
|---|---|
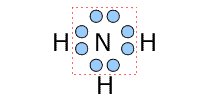 |
中心のNに着目すると、周りにある3つのHと単結合をしています。そして、Nは1つの非共有電子対を持っていますから、中心のNの周りにある3つのHと1つの非共有電子対は、Nを中心とした四面体構造になります。 |
③水
| 電子式 | 構造についての説明 |
|---|---|
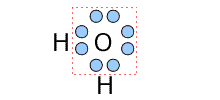 |
中心のOに着目すると、周りにある2つのHと単結合をしています。そして、Oは2つの非共有電子対を持っていますから、中心のOの周りにある2つのHと2つの非共有電子対は、Oを中心とした四面体構造になります。 |
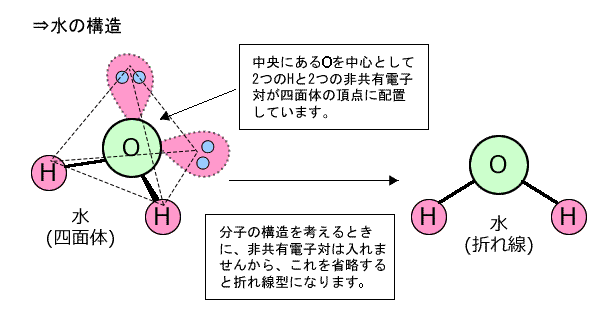
どうでしたか?ちゃんと理論通りになるでしょう?ところで、何でこんなルールが成り立つのか気になりますよね。
結合や非共有電子対は、電子の塊ですよね。ですから、互いに反発力が働きます。そのため、異なる結合や非共有電子対は、可能な限り離れて存在しようとします。
ですから、結合が2本だけの二酸化炭素では、2つの二重結合(くどいようですが電子の塊です。)がCを挟んで正反対の方向に位置することになります。ここが一番電子対同士が離れて存在する位置になります。
次に、結合が3本あるエチレンはどうなるのか?1つの原子の周りにある3つの電子の塊は、それらが三角形の頂点に来るように配置するのが電子対が最も離れて存在する位置になります。
最後に、結合が4本あるメタンはどうでしょう。電子の塊が、4つあればそれぞれが四面体の頂点にあるのが一番遠いですね。そして、どれもC―Hという同じ結合ですから、正四面体になります。
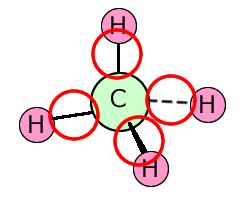
繰り返しますけれど、結合や非共有電子対のような電子の塊はお互いができるだけ遠くに存在しようとするわけです。それで、形が決まるのです。
今回は随分長くなってしまいました。次回は分子でできる物質。分子性物質について説明します。





















































