理論化学
化学講座 第1回:原子のつくり その(1)
原子の構造と原子番号
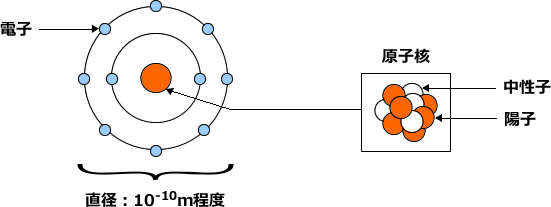
物質を構成する最小単位を原子といいます。原子は直径が約10-10(n)(1Å(オングストローム))で、中央に陽子と中性子からなる原子核があり、その周りを陽子と同じ数の原資が取り巻いています。
| 名称 | 電荷(C) | 質量(相対質量) |
|---|---|---|
| 陽子 | 1.60×10-19 | 1 |
| 中性子 | 0 | 1 |
| 電子 | -1.60×10-19 | 1/1840 |
陽子と電子はそれぞれ正と負に帯電していて、電気量の絶対値は1.60×10-19Cで同じです。この値は電気量の最小単位で、電気素量と呼ばれています。
さて、陽子の数と電子の数は同じで、しかも電荷の絶対値が同じで、しかも符号が逆なので、原子全体で見ると正にも負にも帯電していません。(電気的に中性といいます。)
ところで、原子の化学的性質は何によって決まるのかというと、原子の持つ電子の数によって決まるのです。(正確には、原子の最も外側に配置された最外殻電子の数によって決定されます。詳しくは第2回で。)
そして、原子の持つ電子の数は、原子の持つ陽子の数とおなじなので、原子に含まれる陽子の数で原子の種類を表すことができます。この陽子の数を原子番号といいます。
電子数によって性質が決まるのなら、電子数で原子の種類を表せばいいじゃないか!と思うかもしれませんが、電子は原子が他の原子と結合する際などにやり取りされるため、常に一定の数というわけではないのです。
しかし、他の原子と結合したりしても、その原子の陽子数は変化しないので、種類を表すのには陽子数を用いるようになったわけです。
原子の質量と質量数
原子核のは原子そのものの大きさの数万分の1くらいなので、全体の大きさに占める割合はものすごく小さいです。また、陽子と中性子は電子の1840倍の質量をもっています。
つまり、原子核はものすごく小さいけど、ものすごく重い。原子はふんわりとした電子の雲の中に、小さくてめちゃくちゃ重いかたまりがある。そういうイメージです。
ふんわり?とおもいましたよね。皆さんは電子は小さな粒子のようなものだと思っているかもしれません。でも、実は電子は粒子ではなくて、原子核の周りに雲か霧のようなふんわりと広がっているのです。綿菓子のようなものを想像してもらえばいいかもしれません。
ちょっと話がそれましたが、電子の質量は原子核の質量に比べて無視できる程度です、ですから、原子の質量は原子核の質量であるとみなせます。
その原子核は陽子と中性子の2種類の粒子でできていて、これらの質量は同じですから、陽子の数と中性子の数を足したものを原子の質量の目安にすることができそうですね。
そこで、陽子と中性子の数の和を質量数といい、大雑把に原子の質量を比較するのに使われます。そして、厳密には異なりますが、質量数と原子量はほぼ同じ値になります。
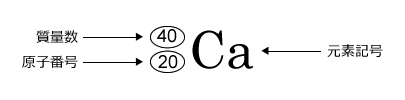
「以下、大学入試には関係ありません」
正電荷を持っている陽子がいっぱいあるのに、何で原子核は正電荷同士の反発力で壊れてしまわないの?という疑問を持つ人がいますが、もっともな質問です。
実は、原子核を形成している陽子と中性子の間には、核力と呼ばれる力が働いていて、その力によって原子核は形を保っているのです。
核力は「強い力」と「弱い力」の2種類があり、湯川秀樹博士がノーベル賞を受賞したのは強い力を生み出す、π中間子という粒子についての研究でした。
力を生み出す粒子・・・?と思った人は比較的健全だと思いますが、実は、力というのは重力や電磁気力のような皆さんが良く知っている力も含めて、それぞれの力に特有のごく小さな粒子をやり取りすることによって生じています。
例えば、2人でキャッチボールをしているのを想像してください。相手とボールを投げ合っている間は、そこから離れることができませんよね。ということはこの2人の間にはキャッチボールをすることによる引力が働いているとみなすことができます。
量子力学という学問では、力を媒介する目に見えない粒子が存在することになっており、重力は重力子、電磁気力は光子、強い力はπ中間子(正確には、中間子に含まれるグルーオン)、弱い力はポゾン、という粒子がそれぞれやり取りされると考えるのです。
陽子と中性子の間ではπ中間子やポゾンがやり取りされていて、それによってひきつけあっているため、原子核に陽子がたくさん集まっていても壊れてしまわないのです。
そして、π中間子やポゾンを陽子と中間子が交換すると、陽子が中性子に、中性子が陽子になるというという変化が起こります。イメージしにくければ、陽子と中性子の間で電荷の交換が行われると考えてください。
このように陽子と中性子がひきつけあって原子核を保っていますが、陽子数と中性子数のバランスが悪いと、原子核は不安定になって、原子核の一部や電磁波や電子などを放出して壊れてしまいます。
この、放出される原子核の一部や電磁波や電子を放射線と呼び、このバランスの悪い原子のことを放射性同位体と呼びます。
「大学入試に関係ない部分、ここまで」
同位体と放射性同位体
ある原子と原子番号が同じなのに中性子数が異なり、質量数の違う原子の事との関係を同位体といいます。
同位体の中には中性子数と陽子数の不均衡から不安定で、放射線を生じて崩壊し、違う元素になるものが存在します。これを放射性同位体といいます。
放射性同位体は各種の検査や年代測定、あるいは放射線源として幅広い分野で活用されており、大学入試では14Cによる年代測定の問題が時々出題されます。





















































