化学講座 第46回:凝固点降下
圧力を一定に保って固体を加熱していくと、徐々に温度が上がっていく。そして、ある程度温度が上がると温度が一定になります。これが融点ですが、融点では融解熱と加熱が釣り合うため温度が動きません。沸点でも同じです。
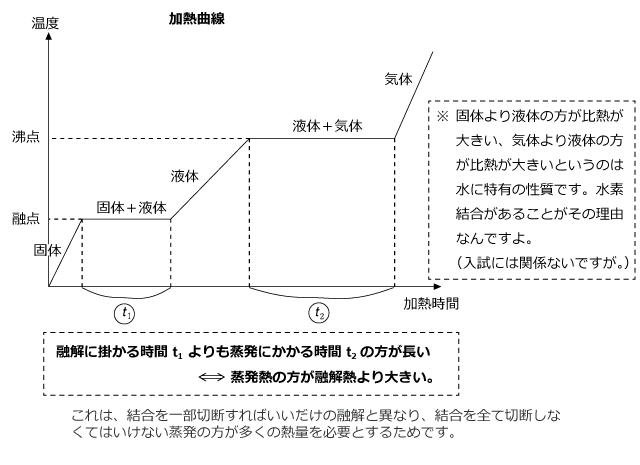
このグラフの左右を入れ替える。即ち、加熱ではなく冷却方向にグラフを見ると、冷却曲線になる。
次項からは、この冷却曲線の一部である凝固点前後での温度変化について説明しようと思います。
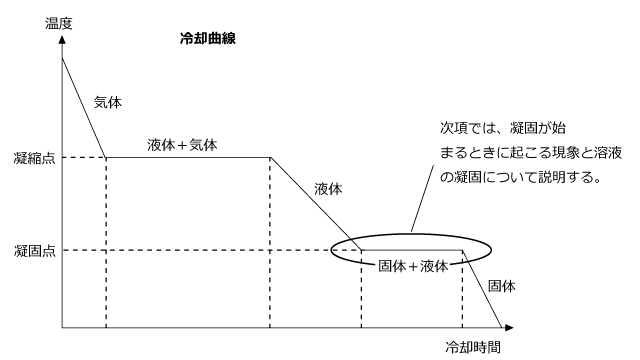
黒い楕円で囲んだ部分、凝固が始まる部分から全て凝固し終わるまでの所を拡大すると、下図のようになります。
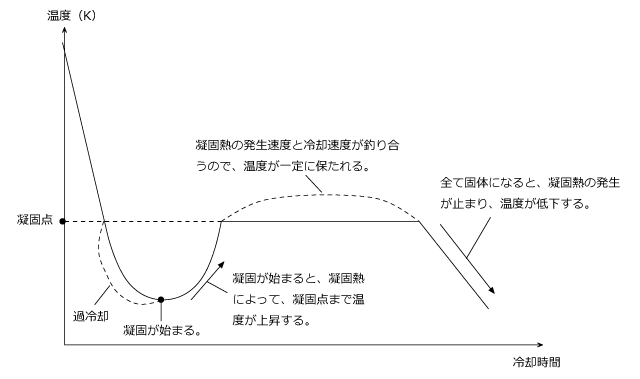
凝固が始まって温度一定になるはずの所が、少し変わった形をしていますね。凝固点を過ぎても一定温度にならず、温度がどんどん下がっていってしまっています。
このように、凝固点を通り過ぎて温度が凝固点以下になった状態を過冷却と言います。
そして、しばらくすると温度が急上昇して、凝固点まで戻り、温度一定になります。この温度の急上昇はなぜ起こるのかというと、凝固熱が生じるためです。
さて、では、溶液の冷却曲線はどうなるでしょう。
溶液では少しグラフが複雑になります。それは凝固点降下という現象のせいです。では、そのグラフを説明する前に凝固点降下についてかるく説明しようと思ます。
凝固点では、凝固速度と融解速度が釣り合った固液平衡という状態になっています。(沸点と同じ考え方です)
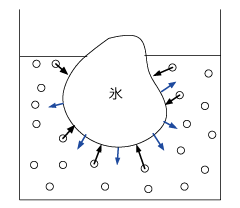 左図のように溶解と凝固の速度が釣り合っている状態が固液平衡です。温度を下げようと周囲から冷却をしても、すぐに凝固熱が生じて温度が上昇します。その繰り返しで温度が一定に保たれるのです。
左図のように溶解と凝固の速度が釣り合っている状態が固液平衡です。温度を下げようと周囲から冷却をしても、すぐに凝固熱が生じて温度が上昇します。その繰り返しで温度が一定に保たれるのです。
では、純溶媒が固液平衡になっているところに溶液に溶質を溶かすとどうなるでしょうか。
溶質は凝固しませんので、液体側は溶質が存在する分だけ凝固速度が遅くなります。そうすると融解が優勢になって融解熱によって周りの温度が低下します。
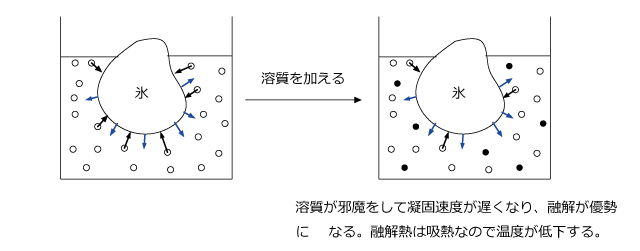
こうして温度が低下すると、融解速度が低下して(融解速度は温度が高いほど大きい。温度が下がると融解速度は小さくなる。)新しい固液平衡になります。
つまり、溶液の凝固点は溶媒の凝固点より低くなるのです。
これが凝固点降下の原理です。氷に食塩を掛けると温度が下がりますが、それは、固液平衡がこのように崩れて新しい平衡になっていく途中で起こる現象だったのです。)また、凝固点がどれくらい下がるかは、溶液の濃度に関係します。濃度が高いほど凝固点は低くなるのです。
水溶液を冷却した時の冷却曲線は下図のようになります。
まず、過冷却から凝固が始まってからも徐々に温度が下がっているところに目を引かれますよね。(①)これはなぜ徐々に下がっているのかというと、これは溶媒から先に凝固していくためです。そのため、溶液の濃度が徐々に高くなっていき、それに合わせて凝固点も徐々に下がっているのです。
それでは、この溶液の凝固点はどこを見ればいいのでしょうか。答えは、①の斜線を左に延長してグラフと交わった点(②)の温度です。この温度を凝固点とします。なぜここなのかというと、過冷却が起こらなかったときは、ここから凝固が始まるからです。つまり、過冷却が無かったと仮定した場合の凝固点という事ですね。
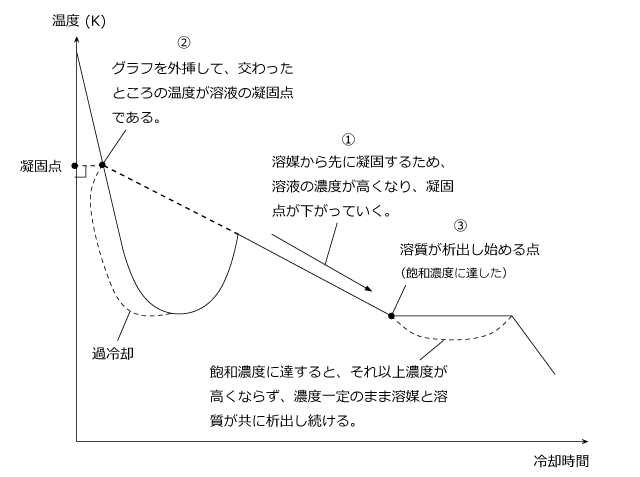
さらに冷却を進めていくと、溶媒のときと同じように温度が変化しなくなる点に達します。(③)これは、飽和濃度に達した瞬間で、ここから先は溶質も一緒に析出して来て濃度が変化しませんので、冷却曲線は冷却時間の軸と平行になります。
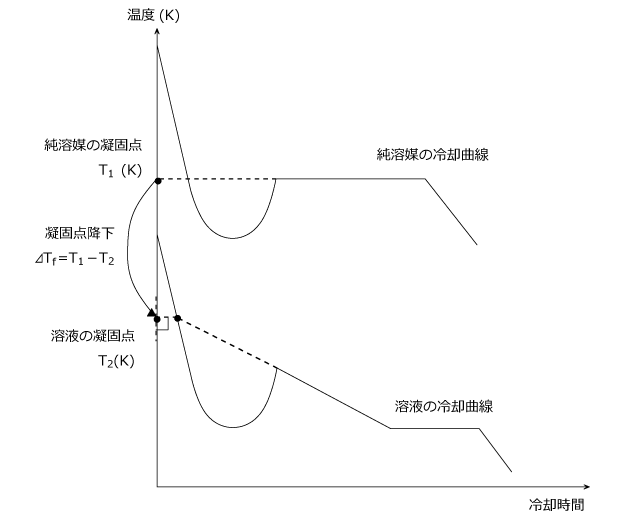
純溶媒と溶液の冷却曲線を同じグラフ上に描いてみると下図のようになります。このとき、凝固点の差を凝固点降下といい、ΔTf で表します。
この値は、溶液の質量モル濃度に比例することが知られていて、ΔTf = KfCm (Cm : 質量モル濃度)
と表されます。Cm は、単純に溶質の質量モル濃度ではなく、電離して生じるイオンや会合して生じる二量体などの粒子の濃度です。Kf はモル凝固点降下と言って、溶媒に固有の値です。
次は問題を解いてみましょう。
- 問題
-
MgCl2を水に溶かして水溶液にする。濃度を Cm(mol/kg)とし、水のモル凝固点降下を
Kf(K・kg/mol) とするとき、この水溶液の凝固点降下の大きさを求めなさい。MgCl2 は水中で完全に電離しているものとする。 - 解答
MgCl2 は水中で次のように電離する。MgCl2 → Mg2+ + 2Cl-
この式から、水溶液中のイオン濃度は 3Cm(mol/kg) となりますね。
よって、凝固点降下度は ΔTf = Kf ・ 3Cm =3 Kf Cm (K)
- 問題
-
電離度 α の CaCl2 水溶液がある。濃度を Cm (mol/kg) とし、水のモル凝固点降下を
Kf (K・kg/mol) とするとき、この水溶液の凝固点降下の大きさを求めなさい。 - 解答
-
このように、電離度が与えられている場合など、反応や電離が途中で終わったり、過不足が出る問題では、反応あるいは電離の前後でのイオンや分子の物質量 ! 濃度等の表を描いて整理するとわかりやすくなります。
CaCl2 のうち割合 α だけ電離するわけですから、CaCl2 は Cm α (mol/kg) が電離しますね。
すると、CaCl2 → Ca2+ + 2Cl- なので、Ca2+ は Cm α (mol/kg)、Cl- は 2 Cm α (mol/kg)となります。
文章にするとこんな感じなのですが、表にすると下のようになります。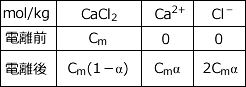
従って、電離後の溶質の濃度は、Cm(1 - α) + Cmα + 2 Cmα = Cm( 1 + 2α ) (mol/kg) となります。
よって、凝固点降下度は ΔTf = Kf Cm (1+2α) (K) - 問題
- CH3COOHをベンゼンに溶かした溶液の濃度は Cm (mol/kg)であった。
ベンゼンのモル凝固点降下を Kf (K・kg/mol)、凝固点降下度を ΔTf(K)とするとき、 CH3COOHの会合度 γ を Cm 、Kf 、ΔTf で表せ。 - 解答
会合って何?とおもいましたよね。実は、酢酸や安息香酸などのカルボン酸を無極性溶媒に溶かすと、会合が起こって 2 分子が向かい合い、見かけ上 1 分子のようになるのです。これを会合と言います。なぜ会合するのかというと、2 分子の極性が打ち消し合って見かけ上、無極性分子になり、無極性溶媒に溶けるのです。
そして、会合すると、見かけ上の濃度が減少して分子量が増加します。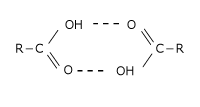
2 分子会合したカルボン酸が左図です。水素結合でうまく結びつきあっていて見かけ上無極性分子のようになっています。
カルボン酸は極性が大きいのに無極性溶媒に溶けやすい理由はこの 2 分子会合をするためです。これは、会合によって 2 つの分子が 1 つになるわけですから、全てのカルボン酸分子が会合したら分子の数が半分に減少しますよね。そうしたら、濃度は半分になります。そして、2 つで 1 つの分子になるということは、分子量が 2 倍になるという事です。
実際は、すべての分子が会合するわけではなくて、一部が会合するだけですけれどね。
会合する分子の割合を会合度といい、γ で表します。さて、会合度 γ 、濃度 Cm(mol/kg) の CH3COOH について考えてみましょう。
会合度 γ ですから、会合する CH3COOH は Cm γ(mol/kg) ですね。
会合は 2CH3COOH → (CH3COOH)2 で表されますので、会合前後の濃度の変化は下表のようになります。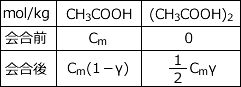
したがって、会合後の溶液の濃度は Cm(1 - γ ) +
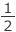 Cmγ = Cm (1 -
Cmγ = Cm (1 - 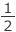 γ) (mol/kg) となります。
γ) (mol/kg) となります。
凝固点効果の式より、ΔTf = KfCm (1 -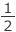 γ)
γ)これを γ について解きます。
まず、KfCm で両辺を割って、(1 -
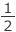 γ) =
γ) = 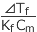
両辺に 2 を掛けて、 2 - γ =
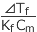
よって、 γ = 2 -
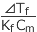 となります。
となります。
- 問題
NaCl 水溶液 Cm (mol/kg) を冷却していく凝固が始まった。しばらくしたとき、この水溶液はまだ完全に凝固しきっていなかったが、温度はこの水溶液の本来の凝固点から ΔT だけ低くなっていた。元の水溶 液の質量を M (kg)、水のモル凝固点降下を Kf として、この温度で何gの氷が生じているか答えよ。
- 解答
-
全て凝固していないのに温度が凝固点以下になった理由は、溶媒である水の一部が凝固して濃度が大きくなったためですね。実際、どれくらい濃度が増えたのかを考えるために x gの水が凝固して氷になったとします。
すると、溶質の量は変わらずに水の量が M (kg) から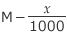 (kg) へと減少したことになりますね。
(kg) へと減少したことになりますね。したがって、濃度は Cm (mol/kg) から、
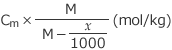 へと上昇します。
へと上昇します。このあたりでついてこれない人がいると思いますので、図を使って説明します。
下図が、凝固前後の濃度、水の量、溶質の物質量です。
x (g) =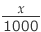 (kg) の水が凝固したので、水の量は M -
(kg) の水が凝固したので、水の量は M - 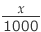 (kg) となります。
(kg) となります。
溶液の濃度が Cm' (mol/kg)になったとすると、溶質の物質量は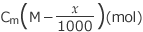 となりますね。
となりますね。
しかし、凝固の前後で溶質の物質量は変化しません。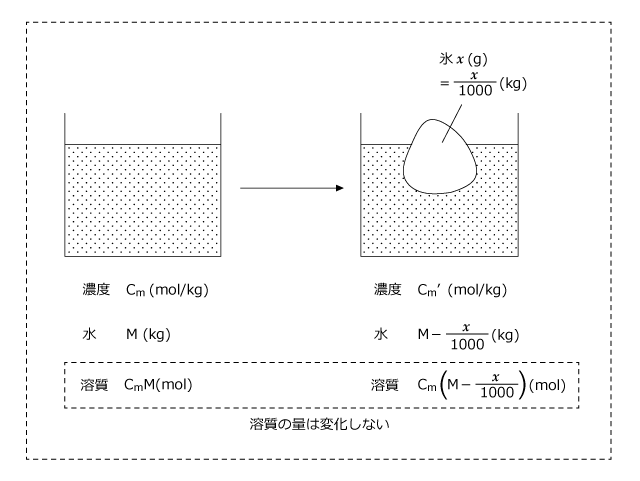
従って CmM =
これを解くと、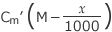 が成立しますね。
が成立しますね。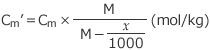 が得られます。
が得られます。


平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

