第2回:原子のつくり その(2)
前回は原子のつくりについて説明しましたが、今回は電子の配置を中心に見ていこうと思います。
電子は原子核の周りを高速で、決められた軌道上を回転しています。
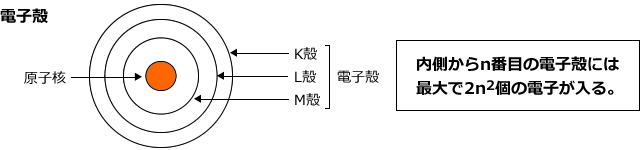
この軌道を電子軌道といい、いくつかの電子軌道が集まって電子殻をつくります。電子殻は何層にも分かれて原子を取り囲んでいます。
電子殻は原子に近いほうからK殻、L殻、M殻・・・という名前が付けられています。なぜK殻から始まるのかというのは結構有名な話ですよね。発見した人が、「いまは発見されていないけど、もっと内側にもあるに違いない」と思い込んだせいです。各殻には入れる電子数が決まっており、K殻には2個、L殻には8個、M殻には18個、内側からn番目の電子殻には2n2個の電子が収容できます。
電子は、この電子殻に、次の基本ルールにしたがって収容されていきます。
- 電子配置のルール(1)
- 原子核に近い殻から入っていく
- 電子配置のルール(2)
- 電子殻の最大収容数以上の電子は入らない。
(一杯になったらその外側の殻に入っていく。)
このルールに基づく電子の配列の仕方を電子配置と言います。
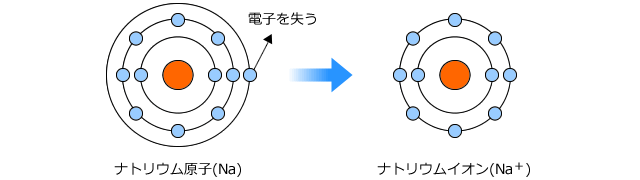
例としてNaの電子配置を書いてみようと思います。
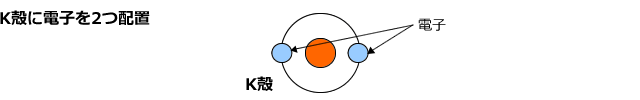
Naは、原子番号が11ですから、11個の電子を持っていますね。まず、K殻に2つの電子を入れます。
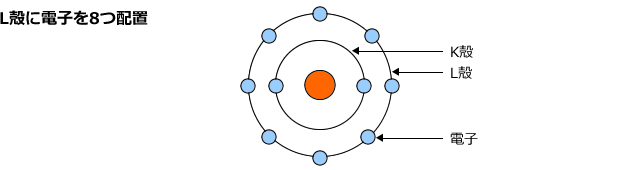
これでK殻は一杯になりましたが、まだ9個のこっていますから、今度はL殻に8個入れます。
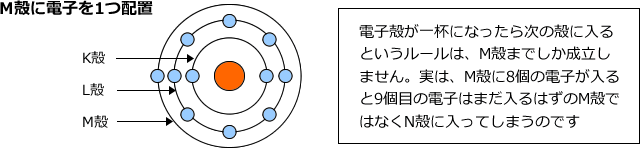
これでL殻も一杯になりました、でももう一つ残っていますね。それはL殻の外側のM殻に入れます。
| 原子 | 原子番号 | 電子殻 | |||
|---|---|---|---|---|---|
| K殻 | L殻 | M殻 | N殻 | ||
| Na | 11 | 2 | 8 | 1 | |
これで11個の電子全てが電子殻に収容されました。一番外側の電子殻はM殻で、ここに1つの電子が入っている状態になっています。
最も外側の電子殻に入っている電子を、最外殻電子といいます。
化学反応というのは、最外殻電子のやり取りです。そして、化学反応のときに電子を放出するか、あるいは受け取るかは最外殻電子数によって決まりますから、最外殻電子数によって原子の性質が決まるのです。
原子は最外殻電子が8個(この状態をオクテットと言います)または一杯になった状態(この状態を閉殻と言います)が最も安定です。ですから、どの原子もその状態を目指して電子のやり取りをします。
ちょっと科学的じゃないですが、原子だって楽をしたいわけです。だから、最外殻電子数が1~3の原子は電子を捨ててしまおうとします。つまり、他の原子に電子を与えるような反応をします。そのほうが、よそから電子をたくさんもらってきて、最外殻電子数を8個にするより楽ですよね。
この辺の話はイオン化エネルギーの所でお話しします。
最外殻電子を捨てると、陽子の数が電子の数より多くなりますから、全体は正に帯電します。このように正に帯電した原子を陽イオンといいます。
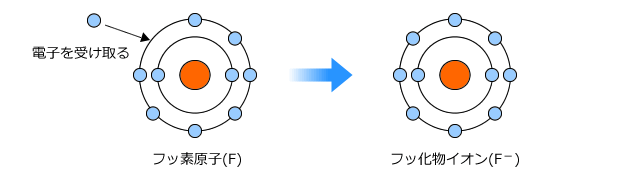
逆に、最外殻電子数が5~7の原子は電子を受け取ろうとします。つまり、他の原子から電子を受け取るような反応をします。理由は、捨てるときと同じです。もらったほうが楽ですね。
最外殻に電子を受け取ると、陽子の数より電子の数が多くなりますから、全体は負に帯電します。このように負に帯電した原子を陰イオンと言います。
陽イオンや陰イオンは、最外殻がオクテットになっているので、安定です。
最外殻電子数によって原子の性質(電子を捨てる反応をするか、受け取る反応をするか)が決まる事がわかりましたね。
こういう風に反応に関わる電子を価電子といいます。つまり、価電子は最外殻電子と同じ意味です。しかし、ちょっと例外なのが希ガスで、希ガス元素は最外殻電子数が8個ですが、これはオクテットなので化学反応をしません。そこで、希ガスの最外殻電子はどれも反応に関わらないという事で価電子数は0個と定義されています。これは結構問題に出てきたりしますから、覚えておいてくださいね。
 |
 |
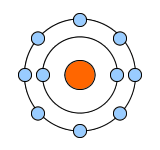 |
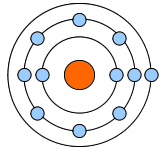
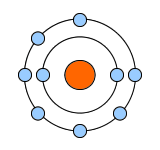
| ナトリウム(Na) | フッ素(F) | ネオン(Ne):希ガス |
|---|---|---|
| 最外殻電子:1個 価電子数:1個 |
最外殻電子:7個 価電子数:7個 |
最外殻電子:8個 価電子数:0個 |
※注:(オクテットの考え方は第三周期までしか利用できませんが、高校化学ではそれで十分です。)
さて、電子配置はわかったと思いますが、もう少し突っ込んで、電子殻中での電子の状態についてお話しします。原子の周りに存在する電子は、バラバラに存在しているのではなく、2つで1つのペアを作っています。このペアのことを電子対と言います。オクテットは、最外殻にこの2つの電子で作られたペアが4組存在している状態です。
この電子対のでき方にもルールがあります。
- 電子配置のルール(3)
- 電子対ができるだけ生じないように収容される。
電子殻に電子が収容されていくとき、できるだけ電子対が生じないように収容されていきます。第二周期の元素を考えてみましょう。
第二周期は最外殻がL殻ですから、最外殻には最大8つの電子が収容されます。したがって最外殻には電子対が4つ入る場所があります。
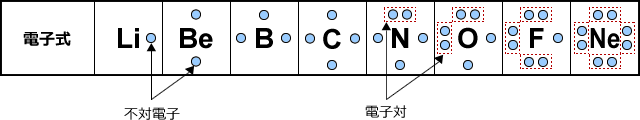
Liは最外殻に1つだけ電子が入りますから、これはペアを作りませんね。
Beは最外殻に2つ電子が入ります。これもペアにならず、電子対が入る場所の2カ所にバラバラに入ります。イメージ的には下図のような具合です。□は電子対が入る部屋だと思ってください、●は電子です。

Bは最外殻に3つ電子が入りますが、これもペアを作らずに3カ所にバラバラに入ります。

Cも同じですね。4カ所に電子が1つずつ入ります。ペアはできません。

Nになると、最外殻電子が5つになりますから、ペアが1つだけできます。このペアになっている電子を電子対、ペアになっていない電子を不対電子と言います。
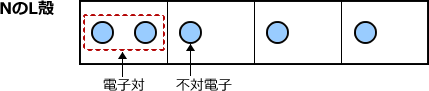
Oは最外殻電子が6つなので電子対2つと不対電子が2つですね。

Fは最外殻電子が7つなので電子対が3つと不対電子が1つです。

Neは最外殻電子が8つなので、電子対が4つになります。電子対4つで電子が8個、オクテットになったわけです。

これで電子配置のルールは分かりましたね。
最外殻電子は反応に寄与する重要な電子なので、元素記号の周りに最外殻電子を・で表す書き方があります。これを電子式といいますが、電子式でも不対電子と電子対の数が分かるように書きます。第二周期の元素の電子式は下図のようになります。
ちなみに、ある原子が作ることができる共有結合の本数を原子価と言います。
共有結合は2つの原子が不対電子を出し合って電子対を作り、それを共有する事によって原子が結びつくことです。
ですから、原子価は不対電子の数に等しく、第二周期の原子価は、Li(1)、Be(2)、B(3)、C(4)、N(3)、O(2)、F(1)、Ne(0)となります。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

