第11回:原子量、分子量、式量、気体の体積
今回は、原子や分子の数え方や質量について考えてみようと思います。
原子は、1つの大きさが10-10mくらいの小さな粒子です。ですから、これを1つ1つ数えていてはらちがあきません。
そこで、鉛筆をダース単位で数えるように、いくつかの原子をひとまとめにして数える事にします。このような考え方はずっと昔からあったのですが、何を基準に考えるかがなかなか決まりませんでした。やっと決まったのは1960年になってからで、「12Cを12g集めたときの12C原子の数を1molとする。」と決められました。
測定の結果、これは約6.02×1023個であることが分かりました。この数字は、化学史上の偉人であるアボガドロにちなんで、アボガドロ定数と呼ばれています。また、molで数えた原子や分子の数を物質量と言います。容器に入っているCO2の物質量は1molなんていう風に使います。
質量数12の炭素12の質量を12とする原子の相対質量を原子量といいます。
すると、原子量は質量数とほとんど同じ値となります。
たとえば、1Hの原子量は1.01、7Liの原子量は6.93というように、質量数と原子量は非常に近い値になります。
なぜ原子量と質量数が完全に一致しないのかというと、陽子と中性子の質量が、厳密には異なること、陽子と中性子が結合する際にほんの少しだけ質量が変化する(質量欠損)こと2つが原因です。
1Hや7Liの原子量は整数に近い値ですが、塩素や銅などは原子量がそれぞれ35.5、63.5と整数からかなり外れた値をとります。
このように、元素全体では原子量は整数である質量数とまったく異なる値をとります。
| 元素 | Cl | Cu | Mg | Zn |
|---|---|---|---|---|
| 原子量 | 35.5 | 63.5 | 24.3 | 65.4 |
原子は質量数と原子量がほとんど同じになるのに対して、元素になると質量数と原子量が食い違うのは、同位体が存在するためです。
同位体を持つ元素の原子量は、同位体の原子量の平均値になるため、整数値から離れてしまうのです。
(当然、同位体を持たない元素の場合、質量数と原子量はほとんど同じになります。)
例えば、塩素には35Clと37Clの2種類の同位体が存在します。35Clと37Clの原子量をそれぞれ35と37とし、存在比率は3:1であるとします。
このとき、Clの原子量は同位体の原子量の平均値ですから

分子は、いくつかの原子の集まりです。ですから、分子1molの質量である分子量は、分子を構成する元素の原子量の和に等しくなりますね。
例えば、HClの分子量は1+35.5 = 36.5、CH3COOHの分子量は12×2+16×2+1×4 = 60 といった具合です。
一方で、イオン結晶や金属結晶、共有結合性結晶は分子を作りませんから分子量は定義できませんが、同じような考え方を組成式に適用して、それを式量と呼びます。
例えば、NaClの式量は23+35.5 = 58.5 です。
これは、Na+ 1molとCl- 1molからなる結晶の質量が58.5gであるという意味です。
また、混合気体の分子量は、構成する気体の分子量の平均値で考えます。(これを平均分子量と言います。)
例題
空気はおもにN2(窒素)とO2(酸素)で構成されていて、N2が80%、O2が20%を占めています。空気がこの2種類の分子から構成されていると仮定して、空気の平均分子量を求めなさい。
【解説・解答】
平均分子量は分子量の平均値です。N2の分子量は28、O2の分子量は32ですから、空気の分子量は以下の式で求める事ができます。
![]()
あまり難しく考えず次のように覚えておけばいいでしょう。
- 1mol = 6.02×1023個
- 原子や分子は1個、2個で数えるには多すぎるので、molという単位で数える。 - 原子量
- 原子を1mol集めた時の質量、同位体がある場合は平均値 - 分子量・式量
- 化合物1molの質量、原子量の和

さて、原子量・分子量・式量は物質の物質量と物質の質量を変換するための量です。
例題
- CO2 3.5molは何gか。
- NH3 3.4gは何molか。
【解説・解答】
- CO2の分子量は44なので、3.5×44=154g
- NH3の分子量は17なので
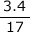 =0.2mol
=0.2mol
さて、ちょっと話が変わりますが、気体の体積は、物質量と温度と体積が等しければどの気体でも同じになります。0℃、1気圧(1.013×105Pa)の事を標準状態と言いますが、標準状態の1molの物質は、種類に関わらず必ず22.4ℓになります。この数字は、今後ずっと付きまとってきます。
これも2つほど例題を解いておきます。
例題
- CO2 3.5molは標準状態で何ℓか。
- 標準状態のNH3 5.6ℓは何molか。
【解説・解答】
- 標準状態で1molの気体の体積は22.4ℓなので、3.5×22.4=78.ℓ
- 標準状態で1molの気体の体積は22.4ℓなので、
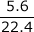 =0.25ℓ
=0.25ℓ
今回はちょっと短いですが、ここまで。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

