第35回:単体と化合物、純物質と混合物、分離と精製
さて、混合物は単にいくつかの純物質が混ざっただけのものですから、適当な処理を施す事によって純物質に分けることができます。この操作を分離といい、分離を繰り返して純度を高める事を精製といいます。
ですから、分離と精製の操作は同じです。次の7種類の分離の方法を覚えておきましょう。
- ろ過 : ろ紙を用いて、固体と液体を分離する
- 蒸留 : 2種類以上の液体の沸点の差を利用して分離する
- 分留 :
- 再結晶 : 温度による溶解度の差を利用して分離する
- 抽出 : 溶媒に対する溶解度の差を利用して分離する
- 昇華 : 昇華性の物質と、昇華性の無い物質を分離する
- クロマトグラフィー : ろ紙やカラムへの吸着力の差を利用して分離する
(1) ろ過(液体と固体の混合物から、固体をろ紙でこしとって分離する)
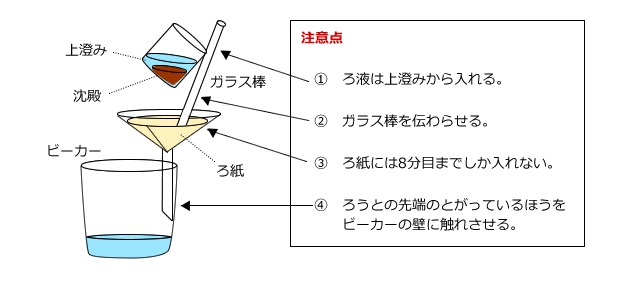
ろ過は、ろ紙を用いて液体と液体に溶けていない沈殿(固体)を分離する方法です。例えば、砂と水の混合物(簡単に言うと泥水)から砂を取り出す場合や、生成した沈殿を取り出す場合には、ろ過を用います。
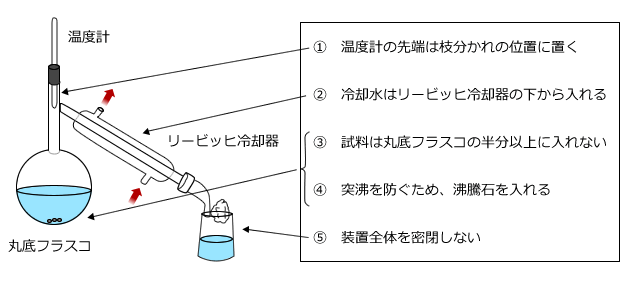
(2) 蒸留(沸点の違いに着目して分離する)
蒸留は、沸点の違いにより分離する方法です。例えば、水とエタノールの混合物を蒸留で分離するためには、下図のような装置を用いて蒸留を行います。
(3) 分留(沸点の違いに着目して分離する)
分留というのは分別蒸留の略称です。蒸留と何が違うの、という事を聞く人も多いのですが、分留は蒸留の一種で、共沸点の無い混合溶液の場合に用います。
共沸点というのは、溶液と蒸気の組成が全く同じになる温度の事で、この温度に達すると、それ以上蒸留で分離・精製をすることができません。しかし、この共沸点が無い溶液は、蒸留によって完全に成分に分離することができるのです。
高校化学でよく出てくるのは石油と液体空気の分留ですね。

平野 晃康
株式会社CMP代表取締役
私立大学医学部に入ろう.COM管理人
大学受験アナリスト・予備校講師
昭和53年生まれ、予備校講師歴13年、大学院生の頃から予備校講師として化学・数学を主体に教鞭を取る。名古屋セミナーグループ医進サクセス室長を経て、株式会社CMPを設立、医学部受験情報を配信するメディアサイト私立大学医学部に入ろう.COMを立ち上げる傍ら、朝日新聞社・大学通信・ルックデータ出版などのコラム寄稿・取材などを行う。

